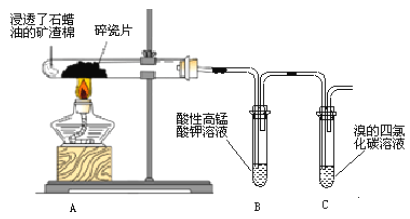
题目内容
【题目】下列实验事实不能用平衡移动原理解释的是( )
A.将NO2球浸泡在冷水和热水中![]()
B.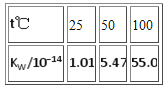
C.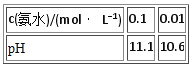
D.向SO2水溶液中滴加氯水后,溶液的pH值减小
【答案】D
【解析】
A.在装置中存在平衡2NO2![]() N2O4,该反应的正反应是放热反应,升高温度,化学平衡向逆反应方向移动,使混合气体颜色加深,可以用平衡移动原理来解释,A不符合题意;
N2O4,该反应的正反应是放热反应,升高温度,化学平衡向逆反应方向移动,使混合气体颜色加深,可以用平衡移动原理来解释,A不符合题意;
B.水是弱电解质,存在电离平衡H2O![]() H++OH-,电离过程是吸热过程,升高温度,促进水的电离,使水电离程度增大,水电离产生的氢离子与氢氧根离子的浓度增大,水的离子积常数增大,可以用平衡移动原理解释,B不符合题意;
H++OH-,电离过程是吸热过程,升高温度,促进水的电离,使水电离程度增大,水电离产生的氢离子与氢氧根离子的浓度增大,水的离子积常数增大,可以用平衡移动原理解释,B不符合题意;
C.氨水中存在平衡NH3H2O![]() NH4++OH-,加水稀释,平衡正向移动,浓度越小,电离程度越大,故0.1mol/L的氨水稀释10倍,pH变化小于1个单位,可以用平衡移动原理解释,C不符合题意;
NH4++OH-,加水稀释,平衡正向移动,浓度越小,电离程度越大,故0.1mol/L的氨水稀释10倍,pH变化小于1个单位,可以用平衡移动原理解释,C不符合题意;
D.向SO2水溶液中滴加氯水,会发生反应:SO2+Cl2+2H2O=H2SO4+2HCl,反应产生的H2SO4、HCl都是强电解质,会电离产生H+,使溶液中c(H+)增大,导致溶液的pH值减小,与化学平衡移动无关,D符合题意;
故合理选项是D。

【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | ||||||||||||||||
[ | c | d | e | f | |||||||||||||
g | h | i | j | k | l | m | |||||||||||
n | o |
请根据要求用元素符号或化学式回答下列问题:
(1)表中所列元素中,原子最外层有2个电子的元素为_________。
(2)画出d元素原子的结构示意图_______________________________,其气态氢化物溶于水显_____________性。(填“酸”或“碱”)
(3)比较元素g和元素h形成的最高价氧化物的水化物的碱性强弱________>__________。
(4)表中j元素在元素周期表中的位置是______________________。
(5)表中所列元素中,最高价氧化物对应水化物碱性最强的是___________(填写化合物的化学式,下同),具有两性的是_____________,