题目内容
【题目】在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为0.65mol / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,该反应中被氧化的元素是 __________(写元素符号),氧化产物为_____________(写化学式)。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气(2KOCN+4KOH+3Cl2=2CO2↑+N2↑+6KCl+2H2O)。若反应转移120mol电子,则消耗0.1mol / LKOH_________L 。
(3)KClO3可用于实验室制O2,若不加催化剂,400℃时分解不生成O2只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,写出该反应的化学方程式_____________ 。
【答案】C KOCN 800 4KClO3![]() KCl+3KClO4
KCl+3KClO4
【解析】
⑴某厂废水中含KCN,其浓度为0.65mol / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 = KOCN+2KCl+H2O,KCN变为KOCN,碳由+2价升高变为+4,因此被氧化的元素是C,氧化产物是化合价升高得到的产物即为KOCN,故答案为:C;KOCN;
⑵2KOCN+ 4KOH+3Cl2 = 2CO2↑+N2↑+6KCl+2H2O,反应物KOCN中氮化合价升高,氯气中氯化合价降低,3mol氯气与2mol KOCN、4molKOH反应,转移6mol电子,若反应转移120 mol电子,则消耗KOH物质的量![]() ,x = 80mol,因此消耗0.1mol / L KOH体积
,x = 80mol,因此消耗0.1mol / L KOH体积![]() ,故答案为800L;
,故答案为800L;
⑶KClO3可用于实验室制O2,若不加催化剂,400℃时分解不生成O2只生成两种盐,其中一种是无氧酸盐,说明为KCl,Cl化合价降低,则另一种物质肯定是Cl化合价升高,则另一种盐的阴阳离子个数比为1:1,说明为KClO4,说明写出该反应的化学方程式4KClO3![]() KCl+3KClO4,故答案为4KClO3
KCl+3KClO4,故答案为4KClO3![]() KCl+3KClO4。
KCl+3KClO4。

 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】实验室制取氯气除了用浓盐酸和二氧化锰反应外还可利用下列反应:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热。下图是实验室利用此反应制备氯气并进行一系列相关实验的装置(夹持设备已略)。
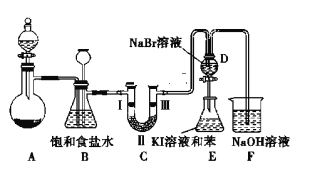
(1)装置B的作用是______ ,实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:_______。
(2)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入______ (选“a”“b”或“c”)
a | b | c | |
Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 干燥的有色布条 |
Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(3)设计装置D、E 的目的是为了比较Cl2、Br2、I2的氧化性强弱.已知Br2的水溶液因浓度不同而呈现橙色或红棕色,I2难溶于水而易溶于苯,且I2的苯溶液为紫红色.当向D中缓缓通入足量Cl2时,可以看到无色溶液逐渐变为红棕色,说明Cl2的氧化性大于Br2,请写出D中对应的离子方程式并用单线桥法表示出电子转移情况:_________ 。打开活塞,将 D中的少量溶液加入E中,振荡E,观察到E中溶液分为两层,上层(苯层)为紫红色.该现象______ (填“能”或“不能”)说明 Br2的氧化性大于I2。
(4)装置F的作用是除去污染性的物质(Cl2、Br2等),已知 Cl2与NaOH反应时产物中可能有NaCl、NaClO、NaClO3,且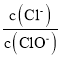 值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
值与温度高低有关.若烧杯中装有500mL 0.2mol/L 的NaOH溶液,则最多可吸收标况下的Cl2的体积为______ L(忽略Cl2溶于水)。
【题目】中学化学中下列各物质间不能实现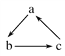 (“→”表示一步完成)转化的是
(“→”表示一步完成)转化的是
选项 | A | B | C | D |
a | CH3CH2OH | CH2=CH2 | Cl2 | C |
b | CH3CHO | CH3CH2Br | HClO | CO |
c | CH3COOH | CH3CH2OH | HCl | CO2 |
A. AB. BC. CD. D
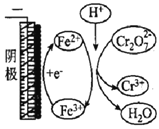
【题目】用电解法处理含Cr2O72-的废水,探究不同因素对含Cr2O72-废水处理的影响,结果如表所示(Cr2O72-的起始浓度、体积、电压、电解时间均相同)。下列说法错误的是
实验 | i | ii | iii | iv |
|
是否加入Fe2(SO4)3 | 否 | 否 | 加入30g | 否 | |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL | |
阴极村料 | 石墨 | 石墨 | 石墨 | 石墨 | |
阳极材料 | 石墨 | 石墨 | 石墨 | 铁 | |
Cr2O72-的去除率 | 0.092% | 12.7% | 20.8% | 57.3% | 实验iii中Fe3+去除Cr2O72-的机理 |
A. 实验ⅱ与实验i对比,其他条件不变,增加c(H+)有利于Cr2O72-的去除
B. 实验ⅲ与实验ⅱ对比,其他条件不变,增加c(Fe3+)有利于Cr2O72-的去除
C. 实验ⅳ中Fe2+循环利用提高了Cr2O72-的去除率
D. 若实验ⅳ中去除0.01 mol Cr2O72-,生成的阳离子全部转化成沉淀,则沉淀的质量是2.06g