题目内容
8.过氧化钠保存不当容易变质生成Na2CO3.(1)某过氧化钠样品已经部分变质,请你设计实验,限用一种溶液,证明过氧化钠已经变质
取少量样品,溶解,加入BaCl2溶液,充分振荡,有白色沉淀,证明Na2O2已经变质
(2)某课外活动小组为了粗略测定过氧化钠的质量分数,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数.图中的E和F构成量气装置,用来测定O2的体积.
①写出装置A、B和C中发生反应的化学方程式:
装置A:CaCO3+2HCl=CaCl2+H2O+CO2↑
装置B:NaHCO3+HCl=NaCl+CO2↑+H2O
装置C:2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑
②NaOH的作用是吸收混合气体中二氧化碳,便于测量氧气的体积
③他们在读出量筒内水的体积数后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为$\frac{39V}{56a}$%.

分析 (1)根据过氧化钠样品已经变质生成Na2CO3,碳酸根离子和Ca2+或Ba2+生成碳酸钙或碳酸钡沉淀;
(2)A装置盐酸和大理石反应制取二氧化碳,B装置用来除去挥发的氯化氢,C装置中过氧化钠和二氧化碳反应,D装置用来吸收未反应的二氧化碳,E、F用来量取生成气体的体积.依据量筒读取液体体积时需要先冷却至室温及和集气瓶液面相平确定操作顺序;依据生成氧气的体积计算物质的量,结合化学方程式计算得到过氧化钠物质的量,得到过氧化钠的质量分数.
解答 解:(1)碳酸根离子和Ca2+或Ba2+生成碳酸钙或碳酸钡沉淀,滴加氯化钡或氯化钙生成白色沉淀,证明含碳酸根离子,说明过氧化钠样品已经变质,
故答案为:取少量样品,溶解,加入BaCl2溶液,充分振荡,有白色沉淀,证明Na2O2已经变质;
(2)①A中盐酸和大理石反应生成氯化钙、二氧化碳和水,反应的离子方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;
B中二氧化碳中氯化氢和碳酸氢钠反应生成氯化钠、二氧化碳和水,反应的离子方程式为:NaHCO3+HCl=NaCl+CO2↑+H2O;
C中过氧化钠与水、二氧化碳都反应,反应的化学方程式分别为:2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑,
故答案为:CaCO3+2HCl=CaCl2+H2O+CO2↑;NaHCO3+HCl=NaCl+CO2↑+H2O;2Na2O2+2CO2═2Na2CO3+O2、2Na2O2+2H2O═4NaOH+O2↑;
②氢氧化钠和二氧化碳反应,吸收二氧化碳,便于测量氧气的体积,
故答案为:吸收混合气体中二氧化碳,便于测量氧气的体积;
③测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,物质的量=$\frac{V×1{0}^{-3}L}{22.4L/mol}$=$\frac{V×1{0}^{-3}}{22.4}$mol,
则样品中过氧化钠的质量分数为=$\frac{\frac{V×1{0}^{-3}}{22.4}mol×2×78g/mol}{ag}$×100%=$\frac{39V}{56a}$%,
故答案为:$\frac{39V}{56a}$%.
点评 本题考查了物质组成的实验探究方法、实验设计方法及化学实验计算的应用,题目难度中等,明确实验原理为解答关键,试题知识点较多、综合性较强,充分考查学生的分析能力及化学计算能力.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案①碱石灰;
②浓硫酸;
③无水CaCl2;
④P2O5.
| A. | ①② | B. | ①③④ | C. | ①②③④ | D. | ②③④ |
| A. | 钢铁在潮湿的空气中容易生锈 | |
| B. | 降低盐酸浓度以减缓盐酸与Zn反应的速率 | |
| C. | SO2氧化成SO3的反应,往往需要使用催化剂 | |
| D. | 恒温恒压的容器中有2NO2?N2O4,若通入Ar,气体的颜色先变浅后逐渐加深 |
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
②反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为4min-5min,原因是浓度减小,反应速率慢.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就采取下列措施以减慢反应速率
A.加少量蒸馏水 B.把锌块换成锌粉 C.加少量NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是加入更加细小的锌粒,增大接触面积,使反应速率加快.
| A. | 高锰酸钾 | B. | 过氧化氢溶液 | C. | 氧气 | D. | 水 |
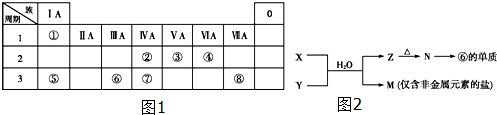
(1)写出由④、⑤、⑧元素形成的既含离子键又含共价键的一种离子化合物的化学式:NaClO.
(2)含元素⑧的单质能与自来水中的有机物反应生成对人体有危害的物质,现已逐步淘汰.下列可代替它作自来水消毒剂的是AC.
A.ClO2 B.AlCl3 C.K2FeO4
(3)W与④是相邻的同主族元素.在下表中写出H2WO3相应性质的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH=Na2SO3+2H2O |
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;
M中阳离子的鉴定方法是取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
如果M中含有元素⑧,M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH+4)>c(H+)>c(OH-).
 .
. 、
、 ,该反应的化学方程式为:2CO2+Na2O2═2Na2CO3+O2.
,该反应的化学方程式为:2CO2+Na2O2═2Na2CO3+O2.