题目内容
3.A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属.试回答:(1)C在元素周期表的第三周期ⅣA族.
(2)在五种元素中,能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是(用具体的分子式表示)H2O>NH3>CH4>SiH4.
(3)A与B形成的三原子分子的结构式是O=C=O,B与D形成的原子个数比为1:1的化合物的电子式是
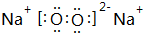 .
.
分析 A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族,A、B、C、D四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素;E的原子半径大于B(O)、小于A(碳),则E为N元素,据此解答该题.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素;E的原子半径大于B(O)、小于A(碳),则E为N元素,据此解答该题.
解答 解:A、B、C、D都是短周期元素,原子半径D>C>A>B,其中A、B处在同一周期,A、C处在同一主族,四种元素在周期表中的大致相对位置为: ,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素;E的原子半径大于B(O)、小于A(碳),则E为N元素.
,A、C处在同一主族,二者质子数相差8,C原子核内质子数等于A、B原子核内质子数之和,故B的质子数为8,则B为O元素;C原子最外层上的电子数是D原子最外层电子数的4倍,故C最外层电子数为4,D的最外层电子数为1,故A为C元素,C为Si元素,D为Na元素;E的原子半径大于B(O)、小于A(碳),则E为N元素.
(1)C为Si元素,处于周期表中第三周期ⅣA族,故答案为:三;ⅣA;
(2)非金属性O>N>C>Si,故氢化物的稳定性为H2O>NH3>CH4>SiH4,故答案为:H2O>NH3>CH4>SiH4;
(3)A与B形成的三原子分子为CO2,其结构式为O=C=O,B与D形成的原子个数比为1:1的化合物为Na2O2,电子式是 ,
,
故答案为:O=C=O; .
.
点评 本题考查元素位置结构性质的关系,题目难度中等,关键是正确推断元素的种类,注意根据原子位置关系及半径大小找出其在周期表中的相对位置.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列化工生产过程的反应原理,不涉及氧化还原反应的是( )
| A. | 氯碱工业 | B. | 从海水中提取镁 | C. | 高炉炼铁 | D. | 侯德榜制碱 |
14.下列各物质的分类、名称(或俗名)、化学式都正确的是( )
| A. | 两性氧化物 氧化铝 Al2O3 | B. | 盐 小苏打 Na2CO3 | ||
| C. | 碱性氧化物 氧化铁 FeO | D. | 酸性氧化物 碳酸气 CO |
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 滴加甲基橙显红色的溶液:K+、NH4+、Cl-、SO42- | |
| B. | 加铝粉能放出氢气的溶液:Na+、NO3-、Cl-、Ba2+ | |
| C. | 使红色石蕊试纸变蓝色的溶液:Na+、ClO-、Cl-、S2- | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1013的溶液:Fe2+、Cl-、MnO4-、SO42- |
8.下列说法正确的是( )
| A. | 乙烯和聚氯乙烯都能发生加成反应 | |
| B. | 苯、乙醇和乙酸都可以发生取代反应 | |
| C. | 乙烷、乙醇和乙酸都可以与钠反应生成氢气 | |
| D. | 纤维素和蛋白质水解产物均是葡萄糖 |