题目内容
Ⅰ.氢气燃烧生成液态水的热化学方程式是2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ/mol 请回答下列问题:
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)
Ⅱ.已知1molCu(s)与适量O2(g)发生反应,生成CuO(s),放出157kJ热量。写出该反应的热化学方程式 。
(1)生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和
(2)若2 mol氢气完全燃烧生成水蒸气,则放出的热量 572 kJ(填“>”、“<”或“=”)
Ⅱ.已知1molCu(s)与适量O2(g)发生反应,生成CuO(s),放出157kJ热量。写出该反应的热化学方程式 。
Ⅰ.(1)小于 (2)< Ⅱ.Cu(s)+1/2O2(g)=CuO(g) △H=-157kJ/mol
试题分析:Ⅰ.(1)氢气燃烧是放热反应,所以生成物的总能量小于反应物的总能量。
(2)应用气态水的能量高于液态水的能量,因此氢气燃烧生成液态水时放出的能量多,则2 mol氢气完全燃烧生成水蒸气,则放出的热量<572 kJ。
Ⅱ.已知1molCu(s)与适量O2(g)发生反应,生成CuO(s),放出157kJ热量,则该反应的热化学方程式Cu(s)+1/2O2(g)=CuO(g) △H=-157kJ/mol。
点评:该题是基础性试题的考查,难度不大。明确反应热与反应物和生成物总能量的相对大小是答题的关键。有利于培养学生的逻辑推理能力和规范答题能力。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
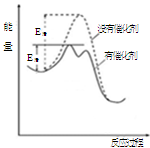
 CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
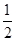 O2===BeO ΔH=-564.3 kJ·mol-1
O2===BeO ΔH=-564.3 kJ·mol-1