题目内容
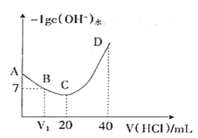
【题目】下列图示与对应的叙述不相符的是
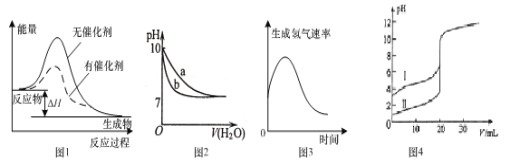
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH变化曲线,其中b表示氨水稀释时pH的变化曲线
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因能是该反应为放热反应
D.图4表示室温下,用0.l00mol ·L-1NaOH溶液分别滴定20.00 mL 0.100 mol ·L-1的盐酸和醋酸,其中I表示的是滴定盐酸的曲线
【答案】BD
【解析】
A、反应物的总能量高于生成物的总能量,是放热反应;加入催化剂,可降低反应的活化能,图象符合,故A正确;
B、相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时,氢氧化钠为强电解质,完全电离,而一水合氨为弱电解质,不完全电离,所以在稀释时,一水合氨的pH变化更为缓慢,所以B表示的为氢氧化钠溶液的稀释曲线,故B错误;
C、镁和盐酸反应,压强对反应速率的影响可以忽略不计,那么考虑温度和浓度的影响,随着反应的进行,酸的浓度降低,但是反应速率升高,说明温度在升高,说明该反应为放热反应,故C正确;
D、HCl为强电解质,醋酸为弱电解质,所以相同浓度的盐酸和醋酸,室温下,醋酸的pH更大,所以I表示的是滴定醋酸的曲线;故D错误;
故选B、D。

练习册系列答案
相关题目