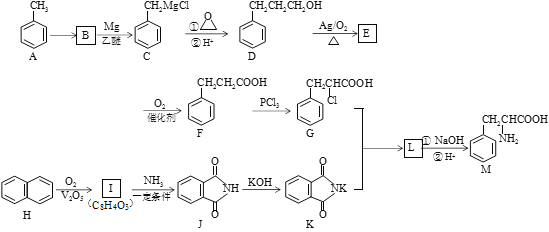
题目内容
【题目】乙二醛是一种低级醛,它有着极其活跃的化学反应性,并有广泛的用途。
I.乙二醛的工业制法如下:
(1)乙醛(CH3CHO)液相硝酸氧化法
在Cu(NO3)催化下,用稀硝酸氧化乙醛制取乙二醛,反应的离子方程式为___________。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是____________ 。
(2)乙二醇(HOCH2CH2OH)气相氧化法
①已知:OHC-CHO(g)+2H2(g)![]() HOCH2CH2OH(g) △H=-78kJ/mol K1
HOCH2CH2OH(g) △H=-78kJ/mol K1
2H2(g)+O2(g)![]() 2H2O(g) △H=-484kJ/mol K2
2H2O(g) △H=-484kJ/mol K2
乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)的相同温度下,该反应的化学平衡常数K=___(用含K1、K2的代数式表示)。
OHC-CHO(g)+2H2O(g)的相同温度下,该反应的化学平衡常数K=___(用含K1、K2的代数式表示)。
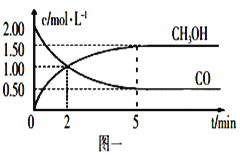
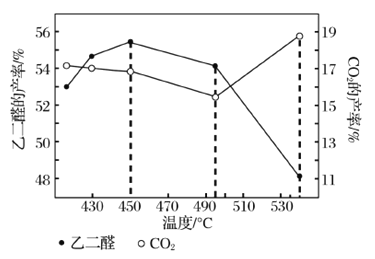
②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是____、____。
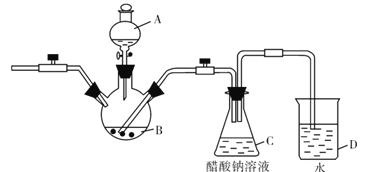
II.乙二醛的用途之一是可以电解氧化制备乙醛酸(OHC-COOH),其生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。
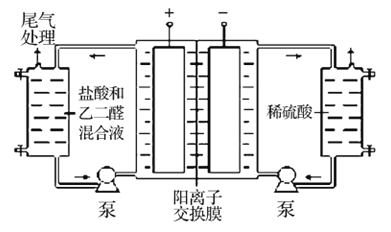
(3)阴极反应式为_________。
(4)阳极液中盐酸的作用,除了产生氯气外,还有__________作用。
(5)保持电流强度为aA,电解tmin,制得乙醛酸mg,列式表示该装置在本次电解中的电流效率η=__________ (已知:法拉第常数为fC·mol-l;![]() )
)
【答案】 3CH3CHO+4H++4NO3- ![]() 3OHC—CHO+4NO↑+ 5H2O 尾气有污染(或“腐蚀设备”等其他合理答案) K2/K1 温度升高,主反应平衡向逆反应方向移动 温度大于495℃,乙二醇大量转化为CO2等副产物 2H++2e-=H2↑ 增强导电性(或“平衡阴极区电解液电荷”等其他合理答案) mf/2220at×100%
3OHC—CHO+4NO↑+ 5H2O 尾气有污染(或“腐蚀设备”等其他合理答案) K2/K1 温度升高,主反应平衡向逆反应方向移动 温度大于495℃,乙二醇大量转化为CO2等副产物 2H++2e-=H2↑ 增强导电性(或“平衡阴极区电解液电荷”等其他合理答案) mf/2220at×100%
【解析】Ⅰ.(1)在Cu(NO3)2催化下,乙醛被氧化为乙二醛,NO3-还原为NO,化学方程式为:3CH3CHO+4H++4NO3- ![]() 3OHC—CHO+4NO↑+ 5H2O,该方法的缺点是尾气有污染。
3OHC—CHO+4NO↑+ 5H2O,该方法的缺点是尾气有污染。
(2)①设前两个反应分别为反应①、②,②-①,由盖斯定律可得![]() ;平衡常数即为反应②与反应①平衡常数的商,则
;平衡常数即为反应②与反应①平衡常数的商,则![]()
![]() 。
。
②HOCH2CH2OH(g)+O2(g)![]() OHC-CHO(g)+2H2O(g)该反应为放热反应,温度升高,平衡逆向移动,乙二醛产率降低;温度大于495℃,乙二醇大量转化为CO2等副产物,乙二醛产率降低。
OHC-CHO(g)+2H2O(g)该反应为放热反应,温度升高,平衡逆向移动,乙二醛产率降低;温度大于495℃,乙二醇大量转化为CO2等副产物,乙二醛产率降低。
Ⅱ.(3)阴极氢离子得电子生成氢气,电极反应式:2H++2e-=H2↑。
(4)阳极液中盐酸可以增强溶液导电性。
(5)tmin内,电极上通过的总电量![]() ,则电极上通过电子的物质的量为
,则电极上通过电子的物质的量为![]() ,制得乙醛酸mg,其物质的量为
,制得乙醛酸mg,其物质的量为![]() ,醛基氧化为羧基,C由+2价变为+4价,则消耗电子的物质的量为
,醛基氧化为羧基,C由+2价变为+4价,则消耗电子的物质的量为![]() ,则电解效率为
,则电解效率为![]() ×100%= mf/2220at×100%。
×100%= mf/2220at×100%。

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案