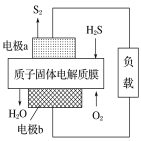
题目内容
【题目】硝化细菌可将NH4+转化为NO3-,发生反应NH4++2O2→NO3-+2H++H2O,下列说法错误的是
A.氧化剂与还原剂的物质的量之比为2:1
B.反应一段时间后,溶液的酸性增强
C.1molNH4+完全反应,转移电子的物质的量为8mol
D.NO3-既是氧化产物又是还原产物,H2O既不是氧化产物也不是还原产物
【答案】D
【解析】
![]() ,铵根离子被氧气氧化为硝酸根,氧化剂是氧气,还原剂是铵根离子,硝酸根既是氧化产物也是还原产物,水是还原产物。
,铵根离子被氧气氧化为硝酸根,氧化剂是氧气,还原剂是铵根离子,硝酸根既是氧化产物也是还原产物,水是还原产物。
A. 氧化剂是氧气,还原剂是铵根,根据方程式二者物质的量之比为2:1,A正确;
B.根据方程式反应生成了氢离子,所以反应一段时间后溶液酸性增强,B正确;
C.铵根中的氮原子为-3价,升高到+5价,1个铵根离子参与反应会转移8个电子,则1mol铵根离子完全反应,转移电子的物质的量为8mol,C正确;
D.![]() 既是氧化产物又是还原产物,氧气中O元素化合价降低,一部分以
既是氧化产物又是还原产物,氧气中O元素化合价降低,一部分以![]() 形式存在,所以
形式存在,所以![]() 是还原产物,D错误;
是还原产物,D错误;
答案选D。

练习册系列答案
相关题目