题目内容
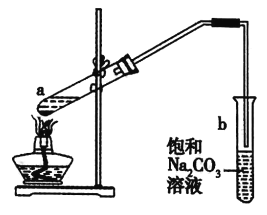
【题目】在乏燃料后处理流程中,四价铀作为铀钚分离的还原剂已广泛使用。在UO2(NO3)2—HNO3—N2H4·HNO3体系下采用电解法制备四价铀,电解总反应为2UO![]() +N2H
+N2H![]() +3H+
+3H+![]() 2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
2U4++N2↑+4H2O,电解装置如图所示。下列说法正确的是( )
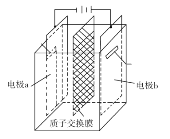
A.电解液中NO![]() 的移动方向:a极→质子交换膜→b极
的移动方向:a极→质子交换膜→b极
B.b极的电极反应式为UO![]() +2H2O+2e-=U4++4OH-
+2H2O+2e-=U4++4OH-
C.若转移4mole-,将有4molH+透过质子交换膜
D.当产生11.2mLN2时,同时生成U4+的质量为0.238g
【答案】C
【解析】
由装置可知,电极a与负极相连,为阴极,电解质溶液为酸性,根据总反应可知电极反应为:2UO![]() +4e-+4H+=2U4++2H2O,电极b与正极相连,为阳极,b电极的反应式为N2H
+4e-+4H+=2U4++2H2O,电极b与正极相连,为阳极,b电极的反应式为N2H![]() -4e-=N2↑+5H+。
-4e-=N2↑+5H+。
A.质子交换膜只允许氢离子通过,硝酸根无法通过质子交换膜,故A错误;
B.电极b与电源正极相连,所以b为阳极,失电子发生氧化反应,根据电解总反应可知b电极的反应式为N2H![]() -4e-=N2↑+5H+,故B错误;
-4e-=N2↑+5H+,故B错误;
C.电解池中阳离子应向阴极移动,所以阳极产生的氢离子会向阴极迁移,结合电荷守恒可知,导线中(外电路)转移4mol电子,则有4mol H+透过质子交换膜,故C正确;
D.未标明气体状态,不能计算,故D错误;
故答案为C。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案【题目】卤素的单质和化合物种类很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。回答下列问题:
(1)溴原子的价层电子排布图为_______。根据下表提供的第一电离能数据,判断最有可能生成较稳定的单核阳离子的卤素原子是________(填元素符号)。
氟 | 氯 | 溴 | 碘 | |
第一电离能/ (kJ·mol-1) | 1 681 | 1 251 | 1 140 | 1 008 |
(2)氢氟酸在一定浓度的溶液中主要以二分子缔合[(HF)2]形式存在,使氟化氢分子缔合的相互作用是____________。碘在水中溶解度小,但在碘化钾溶液中明显增大,这是由于发生反应:I-+I2=I3-,CsICl2与KI3类似,受热易分解,倾向于生成晶格能更大的物质,试写出CsICl2受热分解的化学方程式:_________________________________。
(3)ClO2-中心氯原子的杂化轨道类型为________,与ClO2-具有相同立体构型和键合形式的物质的化学式为____________(写出一个即可)。
(4)如图甲为碘晶体晶胞结构,平均每个晶胞中有________个碘原子,碘晶体中碘分子的配位数为____________。


(5)已知NA为阿伏加德罗常数,CaF2晶体密度为ρ g·cm-3,其晶胞如图乙所示,两个最近Ca2+核间距离为a nm,则CaF2的相对分子质量可以表示为____________。