题目内容
【题目】硫化氢俗称“臭蛋气”,是一种无色具有臭鸡蛋气味的剧毒气体,由含硫物质分解而来,属于常见的酸性有害气体中的一种。研究硫化氢的利用及污染的防治很有意义。
(1)已知下列反应的热化学方程式:
①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
写出H2S分解为单质硫(用S表示)和H2的热化学方程式:___。
(2)H2S在一定条件下发生如下形式的分解:2H2S(g)![]() S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
S2(g)+2H2(g),利用该反应可制备H2和硫磺。在2.0L的恒容密闭容器中充入0.1molH2S发生上述反应,不同温度下测得H2S的转化率与时间的关系如图所示。
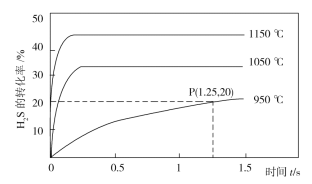
①温度升高时,混合气体的平均摩尔质量减小的原因是___。
②P点时容器内气体压强与起始时气体压强之比为___。
③1050℃时,此反应的平衡常数___(填序号)。
a.等于3.125×10-4 b.大于3.125×10-4
c.小于3.125×10-4 d.无法判断
(3)科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如图所示:
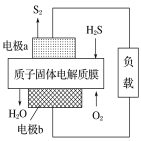
①电极a上发生反应的电极反应式为___。
②当有1molH+经质子膜进入正极区时,反应消耗H2S的体积为___L(标准状况下)。
【答案】H2S(g)=S(s)+H2(g) ΔH=+20kJ·mol-1 该反应是吸热反应,温度升高时,平衡正向移动,气体的物质的量增加,混合气体的平均摩尔质量减小 11∶10 b 2H2S-4e-=S2+4H+ 11.2
【解析】
(2)据图可知温度升高H2S的转化率增大,说明升高温度平衡正向移动,该反应的正反应为吸热反应;
(3)据图可知该装置中H2S转化为S2发生氧化反应,O2转化为H2O发生还原反应,所以电极a为负极,电极b为正极。
(1)H2S分解为单质硫(用S表示)和H2的热化学方程式为H2S(g)= S(s)+H2(g)ΔH;
已知①2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH1=-1123.6kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH2=-296kJ·mol-1
③2H2(g)+O2(g)=2H2O(l) ΔH3=-571.6kJ·mol-1
根据盖斯定律![]() (①-②×2-③)可得ΔH=
(①-②×2-③)可得ΔH=![]() [-1123.6kJ·mol-1-2×(-296kJ·mol-1)-(-571.6kJ·mol-1)]= +20kJ·mol-1;
[-1123.6kJ·mol-1-2×(-296kJ·mol-1)-(-571.6kJ·mol-1)]= +20kJ·mol-1;
(2)①该反应是吸热反应,温度升高时,平衡正向移动,气体的物质的量增加,但总质量不变,所以混合气体的平均摩尔质量减小;
②P点时H2S的转化率为20%,起始投料为0.1molH2S,则列三段式有:
 ;
;
所以P点气体总物质的量为(0.08mol+0.01mol+0.02mol)=0.11mol,恒容容器中气体的压强之比等于物质的量之比,所以P点时容器内气体压强与起始时气体压强之比为0.11:0.1=11:10;
③容器体积为2L,所以P点H2S、S2、H2的浓度分别为0.04mol/L、0.005mol/L、0.01mol/L,则该点的浓度商为![]() = 3.125×10-4,而此时反应还要正向移动,所以950℃时该反应的平衡常数大于3.125×10-4,而该反应为吸热反应,升高温度,平衡常数增大,所以1050℃时,此反应的平衡常数大于3.125×10-4,所以选b;
= 3.125×10-4,而此时反应还要正向移动,所以950℃时该反应的平衡常数大于3.125×10-4,而该反应为吸热反应,升高温度,平衡常数增大,所以1050℃时,此反应的平衡常数大于3.125×10-4,所以选b;
(3)①电极a为负极,H2S被氧化生成S2同时产生氢离子,电极反应式为2H2S-4e-=S2+4H+;
②根据电极反应式可知,当有1molH+经质子膜进入正极时,消耗0.5molH2S,标况下的体积为0.5mol×22.4L/mol=11.2L。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法中一定不正确的是( )
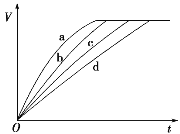
组别 | 对应曲线 | c(HCl)/ mol·L-1 | 反应温度/℃ | 铁的状态 |
1 | a | 30 | 粉末状 | |
2 | b | 30 | 粉末状 | |
3 | c | 2.5 | 块状 | |
4 | d | 2.5 | 30 | 块状 |
A. 第4组实验的反应速率最慢B. 第1组实验中盐酸的浓度大于2.5 mol·L-1
C. 第2组实验中盐酸的浓度等于2.5 mol·L-1D. 第3组实验的反应温度低于30 ℃
【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0