题目内容
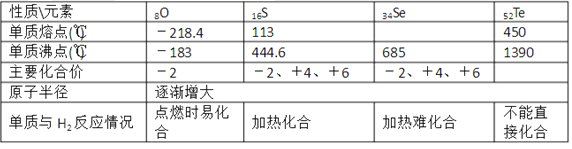
【题目】如表是ⅥA族部分元素的相关性质。
请回答下列问题:
(l)硒的熔点范围可能是____。
(2)碲的化合价可能有____。
(3)氢硒酸有较强的 ____填“氧化性”或“还原性”),因此放在空气中易变质,其可能发生反应的化学方程式为____。
(4)工业上Al2Te可用来制备H2Te,完成下列化学方程式:___ Al2Te3+___ =2Al(OH)3↓+____H2Te↑
【答案】113℃<Se<450℃ -2、+4、+6 还原性 2H2Se+O2=2H2O+2Se↓ 1 6H2O 3
【解析】
(1)由表中数据知,氧族元素单质的熔点随着原子序数增大而增大;
(2)由表中数据知,氧族元素主要化合价相似;
(3)元素的非金属性越弱,其氢化物的还原性越强,硒化氢易被氧气氧化生成Se和水;
(4)根据元素守恒知反应物还有水,根据原子守恒配平方程式.
(1)根据表中数据知,氧族元素单质的熔点随着原子序数增大而增大,所以Se的熔点介于S、Te之间,为113℃<Se<450℃;
(2)根据表中数据知,氧族元素主要化合价相似,根据元素化合价知,Te的化合价可能为-2、+4、+6;
(3)Se元素非金属性较弱,则其简单阴离子还原性较强,所以其氢化物具有还原性,硒化氢易被氧气氧化生成Se和水,反应方程式为2H2Se+O2=2H2O+2Se↓;
(4)根据元素守恒知反应物还有水,根据原子守恒配平方程式为Al2Te3+6H2O=2Al(OH)3↓+3H2Te。

【题目】工业上,可采用还原法处理尾气中NO,其原理:2NO(g)+2H2(g)![]() N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
N2(g)+2H2O(g) △H<0。在化学上,正反应速率方程式表示为v(正)=k(正)·cm(NO)·cn(H2),逆反应速率方程式表示为v(逆)=k(逆)·cx(N2)·cy(H2O),其中,k表示反应速率常数,只与温度有关,m,n,x,y叫反应级数,由实验测定。在恒容密闭容器中充入NO、H2,在T℃下进行实验,测得有关数据如下:
实验 | c(NO)/mol·L-1 | c(H2)/mol·L-1 | v(正)/mol·L-1·min-1 |
① | 0.10 | 0.10 | 0.414k |
② | 0.10 | 0.40 | 1.656k |
③ | 0.20 | 0.10 | 1.656k |
下列有关推断正确的是
A. 上述反应中,正反应活化能大于逆反应活化能
B. 若升高温度,则k(正)增大,k(逆)减小
C. 在上述反应中,反应级数:m=2,n=1
D. 在一定温度下,NO、H2的浓度对正反应速率影响程度相同