题目内容
19.28gFe与足量的稀硫酸反应,求生成标准状况下的氢气多少L?(相对原子质量Fe-56)分析 28gFe的物质的量=$\frac{28g}{56g/mol}$=0.5mol,根据转移电子守恒计算生成氢气物质的量,再根据V=nVm计算生成氢气体积.
解答 解:28gFe的物质的量=$\frac{28g}{56g/mol}$=0.5mol,根据转移电子守恒得生成n(H2)=$\frac{0.5mol×(2-0)}{2×(1-0)}$=0.5mol,生成气体体积=0.5mol×22.4L/mol=11.2L,
答:生成标况下的氢气体积为11.2L.
点评 本题考查氧化还原反应方程式的计算,为高频考点,明确各个物理量之间关系是解本题关键,注意结合转移电子守恒解答,题目难度不大.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
10.下列括号中的物质是除去杂质所需的药品,其中错误的是( )
| A. | NaCl溶液中有杂质Na2SO4(适量的BaCl2溶液) | |
| B. | FeSO4溶液中有杂质CuSO4 (Fe粉) | |
| C. | CO2气体中有少量CO(灼热的氧化铜) | |
| D. | SO2气体中有少量HCl气体(NaOH溶液) |
8.下表是A、B、C、D四种有机物的有关信息:
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为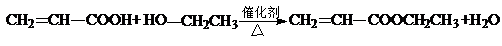 .
.
| A | 1使溴的四氯化碳溶液褪色;②比例模型为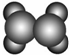 ;③能与水在一定条件下反应生成C ;③能与水在一定条件下反应生成C |
| B | 1C、H两种元素组成;②球棍模型为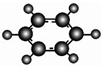 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
| D | ①由C、H、O三种元素组成;②球棍模型为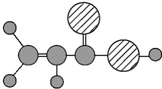 |
(1)A与溴的四氯化碳溶液反应的生成物的名称是1,2-二溴乙烷.
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填序号).
①无色无味液体;②有毒;③不溶于水;④密度比水大;⑤与酸性KMnO4溶液和溴水反应褪色;⑥任何条件下不与氢气反应.写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$ +H2O.
+H2O.(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为酯化反应(取代反应);其化学方程式为
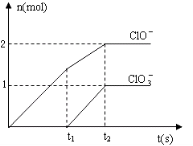 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.
在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应).生成物中含有Cl-、C1O-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如图所示.