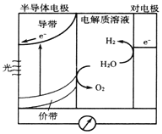
��Ŀ����
����Ŀ�������ִ���ҵ��ζ�������Ƿ�չ�ִ���ҵ���ִ��������ִ���ѧ��������ȱ�ٵ���Ҫ����,���������������(VO2)��һ�������������ϣ�����������(V2O5)�ǽӴ�����������Ĵ���.����ij��ѧС��ӷϷ�������V2O5��V2O4��K2SO4��SiO2��Fe2O3��Al2O3�ȣ��л���V2O5�������û��յ�V2O5�Ʊ�VO2������(��) ��ʽ̼��茶���
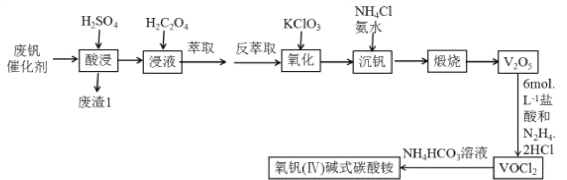
��֪�����������ʱV2O5ת��ΪVO2+,V2O4ת��VO2+
���л���ȡ����ȡVO2+����������ȡVO2+Ҫǿ��
��
�ش��������⣺
(1)д��������1������Ҫ�ɷֵ���;________(������)��
(2)����ȡ��֮ǰ����H2C2O4����ҪĿ��_____________________��
(3)�������������з��������ӷ���ʽ___________________________��
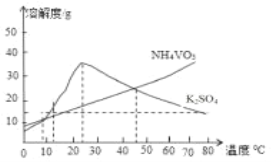
(4)�ù����м����Ȼ�李��������ǻ��շ��Ĺؼ�֮һ�������Ȼ�李���ˮ֮��IJ�����____________���������õ��˹��˲��������˺���ȡ��Һ�����õ���һ�ֲ���������__________��
(5)����������VOC12��ͬʱ����һ����ɫ����Ⱦ�����壬�÷�Ӧ�����������뻹ԭ��������ʵ���֮��Ϊ___________��Ҳ��ֻ��Ũ������V2O5���Ʊ�VOC12 ��Һ���÷����Ļ�ѧ����ʽ��________________��
���𰸡�����ʯӢ���������ά����ѧ����������Ʒ���ͻ���ϵ� ��VO2+��ԭΪVO2+�����ں�����ȡ 3H2O+6VO2++ClO3- = Cl-+6VO2++6H+ ������23����20-25�����ɣ��ᾧ�����ȹ��� �ձ� 1:4 6HCl(Ũ)+V2O5 = 2VOC12 +Cl2��+3H2O
��������
���ݹ�������ͼ�������Ϸ�������H2SO4����£�V2O5ת��ΪVO2+,V2O4ת��VO2+��Fe2O3��Al2O3ת��ΪFe3+��Al3+������1ΪSiO2����ȡǰ����H2C2O4����VO2+��ԭΪVO2+������KClO3��������VO2+��ԭΪVO2+�� ��Ӧ����ʽΪ3H2O+6VO2++ClO3- === Cl-+6VO2++6H+��ͨ������NH4Cl�Ͱ�ˮ���������յõ�V2O5���ټ���6mol/L�������N2H4��2HCl��V2O5��Ӧ�õ�VOCl2����Ӧ����ʽΪ��6HCl+V2O5+N2H4��2HCl=== 4VOC12 +N2��+6H2O��VOCl2��NH4HCO3��Ӧ�õ�����(��) ��ʽ̼��茶��壬�ݴ˽��������Ϣ���������⡣
(1)������������������1��Ҫ�ɷ�ΪSiO2������;������ʯӢ���������ά����ѧ����������Ʒ���ͻ���ϵȣ��ʴ�Ϊ������ʯӢ���������ά����ѧ����������Ʒ���ͻ���ϵȣ�
(2) ��ȡǰ����H2C2O4��Ŀ���ǽ�VO2+��ԭΪVO2+����ǿ��ȡЧ�����ʴ�Ϊ����VO2+��ԭΪVO2+��
(3) ����KClO3��������VO2+����ΪVO2+�� ��Ӧ����ʽΪ3H2O+6VO2++ClO3- === Cl-+6VO2++6H+���ʴ�Ϊ��3H2O+6VO2++ClO3- === Cl-+6VO2++6H+��
(4) �����Ȼ�李���ˮ֮��õ�NH4VO5���ɢۿ�֪20~25��ʱK2SO4�ܽ������ڳ�ȥ���ʵõ�NH4VO5����IJ���Ϊ������23����20-25�����ɣ��ᾧ�����ȹ��ˣ����˺���ȡ��Һ����Ҫ�õ��IJ�������Ϊ�ձ����ʴ�Ϊ��������23����20-25�����ɣ��ᾧ�����ȹ��ˣ��ձ���
(5) N2H4��2HCl��V2O5��Ӧ�õ�VOCl2����Ӧ����ʽΪ��6HCl+V2O5+N2H4��2HCl=== 4VOC12 +N2��+6H2O����������ΪN2����ԭ����ΪVOC12�����ʵ���֮��Ϊ��ѧ������֮�ȣ������������뻹ԭ��������ʵ���֮��Ϊ1:4��ֻ��Ũ������V2O5���Ʊ�VOC12 ��Һʱ����Ӧ����ʽΪ��6HCl(Ũ)+V2O5 = 2VOC12 +Cl2��+3H2O���ʴ�Ϊ��1:4��6HCl(Ũ)+V2O5 = 2VOC12 +Cl2��+3H2O��

����Ŀ���±��Ǽ��ֳ�������ĵ���ƽ�ⳣ��(25�� )
��ѧʽ | H2CO3 | CH3COOH | HClO |
����ƽ�ⳣ�� | K1=4.3��10-7 K2=5.6��10-11 | 1.8��10-5 | 3.0��10-8 |
(1)���ݷ������������ݿ�֪��H2CO3��CH3COOH��HClO����������Դ�ǿ����������_____________________________________��
(2)�����£�0.1molL��1 CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����_________������ĸ��
A��c(H+)B��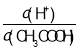 C��c(H+)c(OH��)D��
C��c(H+)c(OH��)D��![]() E��
E��![]()
(3)25��ʱ����Ũ�ȵ�Na2CO3��CH3COONa��NaClO������Һ��pH��С����������_____________________________________��
(4)25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���Һ������Ũ�ȴ�С��ϵ��_________________
(5)���з�Ӧ���ܷ�������______(����ĸ)��
a��![]() +2CH3COOH=2CH3COO-+CO2��+H2O b��ClO-+CH3COOH=CH3COO-+HClO
+2CH3COOH=2CH3COO-+CO2��+H2O b��ClO-+CH3COOH=CH3COO-+HClO
c��![]() +2HClO=CO2��+H2O+2ClO- d��2ClO-+CO2+H2O=
+2HClO=CO2��+H2O+2ClO- d��2ClO-+CO2+H2O=![]() +2HClO
+2HClO
����Ŀ����֪25��ʱ����������ʵĵ���ƽ�ⳣ�����������ʾ���ش��������⣺
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | Ka=1.8��10��5 | Ka1=4.3��10��7 Ka2=5.6��10��11 | Ka=3.0��10��8 |
��1�����ʵ���Ũ�Ⱦ�Ϊ0.1molL��1��������Һ��pH��С�������е�˳����_______���ñ����д��
a��CH3COONa b��Na2CO3 c��NaClO d��NaHCO3
��2�������£�0.1molL��1 CH3COOH��Һ��ˮϡ�����У����б���ʽ�����ݱ�����_____������ĸ��_______
A. c��H+�� B.![]() C. c��H+��c��OH���� D.
C. c��H+��c��OH���� D. ![]() E.
E. ![]()
��3��д�������������Һ��ͨ������������̼�����ӷ���ʽ��__________________
��4��25��ʱ��CH3COOH��CH3COONa�Ļ����Һ������û��ҺpH=6������Һ��
c��CH3COO������c��Na+��=________����ȷ��ֵ����
��5��25��ʱ����a molL��1�Ĵ�����b molL��1�������Ƶ������ϣ���Ӧ����Һǡ�������ԣ���a��b��ʾ����ĵ���ƽ�ⳣ��Ϊ____________________________________
��6����״���£���1.12L CO2ͨ��100mL 1molL��1��NaOH��Һ�У�����Һ������Ũ�ȷ���������е�ʽ�� c��OH����=2c��H2CO3��+_________________________