题目内容
【题目】甲烷、乙烯、环氧乙烷、丁烷都是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6 kJ·mol-1
(g) △H1=-206.6 kJ·mol-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)若反应Ⅲ在一定温度下可自发进行,则△H3_____(填“>”“<”或“=”)0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4 kJg-1,则△H3=___kJmol-1。
(3)实验测得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1<0中,v逆=k逆c2(
(g) △H1<0中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填“大于”“小于”或“等于”)k逆增大的倍数。
②若在1 L的密闭容器中充入1 mol CH2=CH2(g)和1 mo1O2(g),在一定温度下只发生反应I,经过10 min反应达到平衡,CH2=CH2(g)的转化率为40%,则010 min内v(O2)=_________,![]() =______(保留两位有效数字)。
=______(保留两位有效数字)。
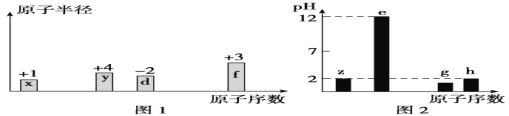
(4)下列有关环氧乙烷制备的说法正确的是_____(填字母)。
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水

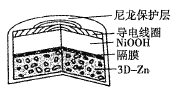
(5)一种以天然气为燃料的固体氧化物燃料电池的原理如图所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。
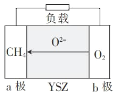
a极上的电极反应式为_____;若电路中转移0.1 mol电子,则消耗标准状况下CH4的体积为_____L。
【答案】< -2615.8 小于 0.02 mol/(L·min) 0.56 BC CH4-8e-+4O2-=CO2+2H2O 0.28
【解析】
(1)反应Ⅲ是体系混乱程度减少的反应△S<0,若在一定温度下反应可自发进行,根据△G=△H-T△S<0,△S<0,则△H<0;
(2)乙烯的热值为50.4 kJg-1,则1 mol乙烯的燃烧热为-50.4 kJg-1×28 g/mol=-1411.2 kJ/mol,根据盖斯定律,将(I+III)÷2,整理可得CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1),△H=![]() =-1411.2 kJ/mol,所以△H3=2△H-△H1=2×(-1411.2 kJ/mol)-(-206.6 kJ/mol)=-2615.8 kJ/mol;
=-1411.2 kJ/mol,所以△H3=2△H-△H1=2×(-1411.2 kJ/mol)-(-206.6 kJ/mol)=-2615.8 kJ/mol;
(3)反应2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,所以v逆增大的比v正增大的多,使得v正<v逆,所以化学平衡逆向移动。v逆=k逆c2(
(g) △H1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,所以v逆增大的比v正增大的多,使得v正<v逆,所以化学平衡逆向移动。v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2),因此达到平衡后,仅升高温度,k正增大的倍数小于k逆增大的倍数;
),v正=k正c2(CH2=CH2)c(O2),因此达到平衡后,仅升高温度,k正增大的倍数小于k逆增大的倍数;
②根据方程式可知乙烯与氧气反应的物质的量的比是2:1,由于开始时加入了1 mol乙烯,达到平衡时乙烯转化率为40%,则反应的乙烯的物质的量为1 mol×40%=0.4 mol,所以反应的氧气的物质的量是0.2 mol,故010 min内v(O2)=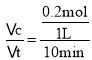 =0.02 mol/(L·min);反应达到平衡时c(CH2=CH2)=(1 mol-0.4 mol)÷1 L=0.6 mol/L,c(O2)=(1 mol-0.2mol)÷1 L=0.8 mol/L,c(
=0.02 mol/(L·min);反应达到平衡时c(CH2=CH2)=(1 mol-0.4 mol)÷1 L=0.6 mol/L,c(O2)=(1 mol-0.2mol)÷1 L=0.8 mol/L,c(![]() )=0.4 mol÷1 L=0.4 mol/L,化学平衡常数K=
)=0.4 mol÷1 L=0.4 mol/L,化学平衡常数K=![]() =
=![]() ;由于反应达到平衡时v正=v逆,所以k正c2(CH2=CH2)c(O2)= k逆c2(
;由于反应达到平衡时v正=v逆,所以k正c2(CH2=CH2)c(O2)= k逆c2(![]() ),故
),故![]() =
=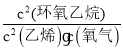 =K=
=K=![]() =0.56;
=0.56;
(4)A.根据图示可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可能是温度对副反应的影响较小造成的,但不能得到初始温度对乙烯的转化率影响不大的结论,实际上升高温度,物质转化率相对有较大影响,A错误;
B.流速越快,反应物接触时间越短,消耗乙烯的量越少,导致乙烯转化率下降,B正确;
C.若进料气中O2比例增大,环氧乙烷产率降低,其主要原因是环氧乙烷与氧气发生副反应转化为二氧化碳和水,C正确;
故合理选项是BC;
(5)根据图示可知在a电极通入甲烷为负极,失去电子发生氧化反应,电极反应式为CH4-8e-+4O2-=CO2+2H2O,每有1 molCH4发生反应,转移8 mol电子;若电路中转移0.1 mol电子,消耗CH4的物质的量为n(CH4)=![]() ×0.1 mol=0.0125 mol,其在标准状况下的体积V(CH4)=n·Vm=0.0125 mol×22.4 L/mol=0.28 L。
×0.1 mol=0.0125 mol,其在标准状况下的体积V(CH4)=n·Vm=0.0125 mol×22.4 L/mol=0.28 L。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案