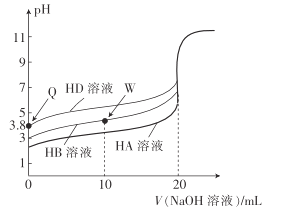
题目内容
【题目】无水MgBr2可用作催化剂,实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图1。
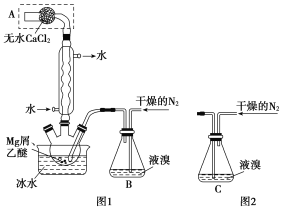
主要步骤如下:
步骤1:三颈瓶中装入10g镁屑和150mL无水乙醚;装置B中加入15mL液溴。
步骤2:缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3:反应完毕后恢复至室温,过滤除去镁,滤液转移至另一干燥的烧瓶中,冷却至0℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4:常温下用苯溶解粗品,冷却至0℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160℃分解得无水MgBr2产品。
已知:①Mg和Br2反应剧烈放热;MgBr2具有强吸水性
②MgBr2+3C2H5OC2H5→MgBr2·3C2H5OC2H5
请回答下列问题:
(1)仪器A的名称是__。实验中不能用干燥空气代替干燥N2,原因是__。
(2)如将装置B改为装置C(图2),可能会导致的后果是__。
(3)有关步骤4的说法,正确的是__。
A.可用95%的乙醇代替苯溶解粗品
B.洗涤晶体可选用0℃的苯
C.加热至160℃的主要目的是除去苯
D.该步骤的目的是除去乙醚和可能残留的溴
(4)为测定产品的纯度,可用EDTA(简写为Y)标准溶液滴定,反应的离子方程式:Mg2++Y4-=Mg+Y2-
①滴定前润洗滴定管的操作方法是__。
②测定前,先称取0.2500g无水MgBr2产品,溶解后,用0.0500mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50mL,则测得无水MgBr2产品的纯度是__(以质量分数表示)。
【答案】干燥管 防止镁屑与氧气反应生成MgO阻碍Mg和Br2的反应 会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患 BD 从滴定管上口加入少量待盛液,平斜着缓慢转动滴定管,使液体润湿整支滴管内壁,然后从下口放出,重复2~3次 97.5%
【解析】
(1)根据仪器A的特点,仪器A为干燥管;空气中含有氧气,能与金属镁反应生成MgO,不能用干燥空气代替N2的原因是防止镁与氧气反应生成MgO;
(2)Mg与液溴反应剧烈放热,因此装置B改为装置C,导致会将液溴快速压入三颈瓶,反应过快大量放热而存在安全隐患;
(3)A.95%的乙醇中含有水,溴化镁有强烈的吸水性,错误;
B.加入苯的目的是除去乙醚和溴,洗涤晶体用0℃的苯,可以减少产品的溶解,正确;
C.加热至160℃的主要目的是分解三乙醚合溴化镁得到溴化镁,不是为了除去苯,错误;
D.该步骤是为了除去乙醚和溴,正确;
(4)①从滴定管上口加入少量待盛液,平斜着缓慢转动滴定管,使液体润湿整支滴管内壁,然后从下口放出,重复2~3次;
②根据反应方程式,n(MgBr2)=n(EDTA)=26.50×10-3L×0.05mol/L=1.325×10-3mol,其质量为1.325×10-3 mol×184g/mol=0.2438g,产品的纯度为![]() ×100%=97.52%。
×100%=97.52%。

 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案【题目】石墨、石墨烯及金刚石是碳的同素异形体。
(1)以Ni—Cr—Fe为催化剂,一定条件下可将石墨转化为金刚石。基态Fe原子未成对电子数为________。设石墨晶体中碳碳键的键长为am,金刚石晶体中碳碳键的键长为bm,则a________(填“>”“<”或“=”)b,原因是_______。
(2)比较表中碳卤化物的熔点,分析其熔点变化的原因是_________。
CCl4 | CBr4(α型) | CI4 | |
熔点/℃ | -22.92 | 48.4 | 168(分解) |
(3)金刚石的晶胞如图1所示。已知ZnS晶胞与金刚石晶胞排列方式相同,若图1中a与ZnS晶胞中Zn2+位置相同,则S2-在ZnS晶胞中的位置为________。

(4)石墨烯中部分碳原子被氧化后,转化为氧化石墨烯。
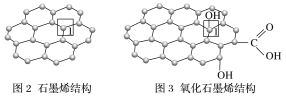
①在图3所示的氧化石墨烯中,采取sp3杂化形式的原子有________(填元素符号)。
②石墨烯转化为氧化石墨烯时,1号C与相邻C原子间键能的变化是________(填“变大”“变小”或“不变”)。
(5)石墨烯具有很大的比表面积,有望用于制超级电容器。若石墨烯中碳碳键的键长为am,12g单层石墨烯单面的理论面积约为________m2(列出计算式即可)。