题目内容
4.电解含重水(D2O)的普通水,当电路中有4mol电子通过时,测得两惰性电极上共产生36.5g气体,则在生成的气体中${\;}_{1}^{2}$H和${\;}_{1}^{1}$H的质量比为( )| A. | 1:4 | B. | 1:5 | C. | 2:5 | D. | 2:7 |
分析 先根据方程式判断氢气和氧气的体积之比,根据电路中有4mol电子通过时计算氧气的质量,再利用质量和计算氢气的质量,最后列方程组进行计算.
解答 解:电解水的方程式为2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,由方程式知,氢气和氧气的体积之比为2:1,当电路中有4mol电子通过时,生成氢气为2mol,生成氧气为1mol
,则氧气的质量=1×32=32g,所以2mol氢气的质量为36.5-32=4.5g,所以氢气的平均摩尔质量=$\frac{4.5}{2}$=2.25g/mol,所以设在生成的气体中${\;}_{1}^{2}$H和${\;}_{1}^{1}$H的质量分别为x、y,所以$\left\{\begin{array}{l}{x+y=4.5}\\{\frac{x}{4}+\frac{y}{2}=2}\end{array}\right.$,解得x=1,y=3.5,所以生成的气体中${\;}_{1}^{2}$H和${\;}_{1}^{1}$H的质量比为1:3.5=2:7,
故选D.
点评 本题以电解原理为载体考查了物质的量的有关计算,难度不大,充分利用平均摩尔质量法是解答本题的关键.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
12.有机物 最多可能有多少个碳原子共面( )
最多可能有多少个碳原子共面( )
 最多可能有多少个碳原子共面( )
最多可能有多少个碳原子共面( )| A. | 12 | B. | 11 | C. | 10 | D. | 9 |
19.把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静电的玻璃棒接近液体细流时,细流可能发生偏移的是( )
| A. | CCl4 | B. | C2H5OH | C. | CS2 | D. | C6H6 |
9.2015年4月,于敏获颁“影响世界华人终身成就奖”.“钚--239”是“于敏型”氢弹的重要原料.下列说法正确的是( )
| A. | 239Pu原子的原子核中含有239个质子 | |
| B. | 238Pu、239Pu和241Pu属于不同的核素 | |
| C. | 238Pu与238U在元素周期表中的位置相同 | |
| D. | 239Pu衰变成235U属于化学变化 |
16.经测定乙醇的化学式是C2H6O,由于有机物普遍存在同分异构现象,推测乙醇的结构可能是图1两种之一.
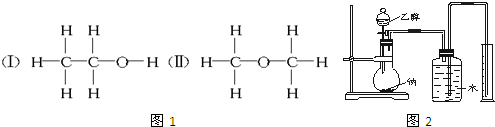
为测定其结构,应利用物质的特殊性进行定性、定量实验.现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四位同学直接利用如图2给定装置开始进行实验确定乙醇的结构.
(1)学生甲得到一组实验数据:
根据以上数据推断乙醇的结构为Ⅰ(用Ⅰ、Ⅱ表示),理由为得到H2的体积说明乙醇分子中有一个H与其他五个H不同,从而确定乙醇分子的结构Ⅰ
(2)同学乙分别准确称量4.60g 乙醇进行多次实验,结果发现以排开量筒内的体积作为生成的H2体积,换算成标准状况后都小于1.12L,如果忽略量筒本身及乙同学读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?不正确(填“正确”或“不正确”).如果你认为正确,请说明理由;如果你认为不正确,那产生这种情况的原因应该是什么?广口瓶与量筒之间玻璃导管中水柱的体积没计算在内
(3)同学丙认为实验成功的关键有:①装置气密性要良好,②实验开始前准确确定乙醇的量,③钠足量,④广口瓶内水必须充满,⑤氢气体积的测算方法正确、数据准确.其中正确的有①②③⑤.(填序号)
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需要知道的数据是所给乙醇样品的密度和体积.

为测定其结构,应利用物质的特殊性进行定性、定量实验.现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四位同学直接利用如图2给定装置开始进行实验确定乙醇的结构.
(1)学生甲得到一组实验数据:
| 乙醇的物质的量/mol | 氢气的体积/L |
| 0.10 | 1.12(标准状况) |
(2)同学乙分别准确称量4.60g 乙醇进行多次实验,结果发现以排开量筒内的体积作为生成的H2体积,换算成标准状况后都小于1.12L,如果忽略量筒本身及乙同学读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?不正确(填“正确”或“不正确”).如果你认为正确,请说明理由;如果你认为不正确,那产生这种情况的原因应该是什么?广口瓶与量筒之间玻璃导管中水柱的体积没计算在内
(3)同学丙认为实验成功的关键有:①装置气密性要良好,②实验开始前准确确定乙醇的量,③钠足量,④广口瓶内水必须充满,⑤氢气体积的测算方法正确、数据准确.其中正确的有①②③⑤.(填序号)
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需要知道的数据是所给乙醇样品的密度和体积.
13.下列离子反应方程式书写正确的是( )
| A. | 金属钠与水反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| C. | 氯气溶于水中:Cl2+H2O═2H++Cl-+ClO- | |
| D. | NH4HCO3溶于过量的浓KOH溶液中:NH${\;}_{4}^{+}$+OH-═NH3↑+H2O |
14.下列化学用语的表述不正确的是( )
| A. | 质子数与中子数相等的氢原子符号${:}_{1}^{1}$H | |
| B. | 乙烯的比例模型: | |
| C. | 双氧水的电子式:${H}_{•}^{•}{\stackrel{••}{\underset{••}{O}}}_{•}^{•}{\stackrel{••}{\underset{••}{O}}}_{•}^{•}$H | |
| D. | 次氯酸的结构式:H-O-Cl |

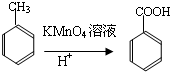
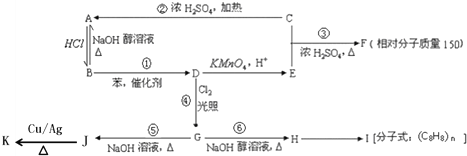
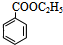 ,I
,I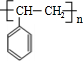 .
.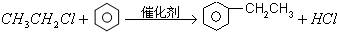 ;G→H:
;G→H: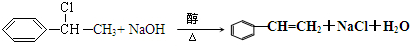 .
.