题目内容
16.经测定乙醇的化学式是C2H6O,由于有机物普遍存在同分异构现象,推测乙醇的结构可能是图1两种之一.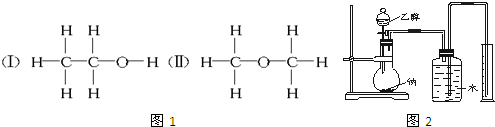
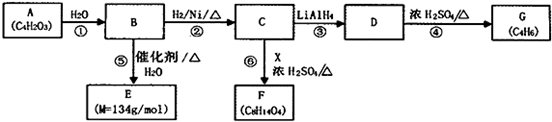
为测定其结构,应利用物质的特殊性进行定性、定量实验.现给出乙醇、钠、水及必要的仪器,请甲、乙、丙、丁四位同学直接利用如图2给定装置开始进行实验确定乙醇的结构.
(1)学生甲得到一组实验数据:
| 乙醇的物质的量/mol | 氢气的体积/L |
| 0.10 | 1.12(标准状况) |
(2)同学乙分别准确称量4.60g 乙醇进行多次实验,结果发现以排开量筒内的体积作为生成的H2体积,换算成标准状况后都小于1.12L,如果忽略量筒本身及乙同学读数造成的误差,那么乙认为可能是由于样品中含有少量水造成的,你认为正确吗?不正确(填“正确”或“不正确”).如果你认为正确,请说明理由;如果你认为不正确,那产生这种情况的原因应该是什么?广口瓶与量筒之间玻璃导管中水柱的体积没计算在内
(3)同学丙认为实验成功的关键有:①装置气密性要良好,②实验开始前准确确定乙醇的量,③钠足量,④广口瓶内水必须充满,⑤氢气体积的测算方法正确、数据准确.其中正确的有①②③⑤.(填序号)
(4)同学丁不想通过称量乙醇的质量来确定乙醇的量,那么他还需要知道的数据是所给乙醇样品的密度和体积.
分析 (1)根据乙醇能和金属钠反应生成氢气来推测乙醇中含有醇羟基;
(2)根据金属钠和乙醇以及水的反应来计算,会发现等质量的水产生的氢气比等质量的乙醇多;
(3)根据实验者可能会存在的干扰因素:装置中含有空气,气密性不好会影响实验结果,金属钠和乙醇的量的相对多少等因素来分析判断得出结论;
(4)根据m=ρV可以间接计算质量,不用称量质量的多少.
解答 解:(1)实验数据表明:1mol C2H6O与足量的钠反应,产生11.2L H2,即0.5mol H2,也就是1mol H.说明1个C2H6O分子中只有1个氢原子被Na置换,故结构式为Ⅰ而不是Ⅱ,
故答案为:Ⅰ;得到H2的体积说明乙醇分子中有一个H与其他五个H不同,从而确定乙醇分子的结构Ⅰ;
(2)乙同学认为样品中含少量水是错误的,因为2Na+2H2O═2NaOH+H2↑,等质量的水产生的氢气比等质量的乙醇多,应大于1.12L,真正的原因是广口瓶与量筒之间玻璃导管中水柱的体积没计算在内,混有水产生的氢气大于1.12L;可能乙醇中混有丙醇等杂质;或者加入的钠不够,
故答案为:不正确;广口瓶与量筒之间玻璃导管中水柱的体积没计算在内;
(3)同学丙关于实验成功的关键的五点中,只有④是不必要的,因为反应的烧瓶和导管中都存在空气,并不影响实验的准确性,
故答案为:①②③⑤;
(4)同学丁不想称量乙醇的质量,则只有量取其体积,因此必须知道乙醇的密度和体积,故答案为:所给乙醇样品的密度和体积.
点评 本题考查学生实验设计能力,测量气体体积的方法及分析误差的能力,是一个探究性实验,难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.能正确表示蛋白质分子由简到繁的结构层次的一组数字是( )
①氨基酸
②C、H、O、N等元素
③氨基酸分子相互结合
④多肽
⑤形成一定的空间结构.
①氨基酸
②C、H、O、N等元素
③氨基酸分子相互结合
④多肽
⑤形成一定的空间结构.
| A. | ①②③④⑤ | B. | ②①③④⑤ | C. | ②①③⑤④ | D. | ②①④③⑤ |
4.电解含重水(D2O)的普通水,当电路中有4mol电子通过时,测得两惰性电极上共产生36.5g气体,则在生成的气体中${\;}_{1}^{2}$H和${\;}_{1}^{1}$H的质量比为( )
| A. | 1:4 | B. | 1:5 | C. | 2:5 | D. | 2:7 |
11.下列叙述错误的是( )
| A. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 | |
| B. | 用溴水一种试剂可鉴别甲苯、乙烯、乙醇、四氯化碳四种液体 | |
| C. | 用水可区分苯和溴苯 | |
| D. | 用金属钠可区分乙醇和乙醚 |
1.下列有关物质应用的说法中,不正确的是( )
| A. | Na2C03是发酵粉的主要成分之一 | B. | Mg0常用作耐高温材料 | ||
| C. | SiO2可用于制造光导纤维 | D. | 工业上可用Cl2制造漂白粉 |
5.下列过程应用于工业生产的是( )
| A. | 锌与稀硫酸反应制取氢气 | B. | 氯化铵和氢氧化钙制取氨气 | ||
| C. | 浓盐酸和二氧化锰反应制取氯气 | D. | 氯气与石灰乳反应制取漂白粉 |

 .
. .
. .
.