题目内容
6.相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)?2SO3(g)△H=-197kJ/mol.实验测得起始、平衡时的有关数据如表:| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系 能量的变化 | |||
| SO2 | O2 | SO3 | Ar | ||
| 甲 | 2 | 1 | 0 | 0 | 放出热量:Q1 |
| 乙 | 1.8 | 0.9 | 0.2 | 0 | 放出热量:Q2 |
| 丙 | 1.8 | 0.9 | 0.2 | 0.1 | 放出热量:Q3 |
| A. | Q1=Q2=Q3 | |
| B. | 达到平衡时,丙容器中SO2的体积分数最大 | |
| C. | 甲、乙、丙3个容器中反应的平衡常数不相等 | |
| D. | 若在上述条件下反应生成2molSO3(s)的放热大于197kJ |
分析 A、从起始量分析,正向反应 是放热反应,逆向进行的反应是吸热反应;
B、从恒温恒容容器中加入惰性气体,增加总压,分压不变,平衡不动分析判断;
C、从平衡常数是只与温度有关的物理量;
D、从反应的焓变意义和物质聚集状态分析判断.
解答 解:A、三个容器内尽管最终平衡相同,但起始量不同反应的热效应不同,正向反应是放热反应,逆向反应是吸热反应,所以Q1>Q2=Q3,故A错误;
B、因为甲、乙、丙最终达到的平衡状态相同,所以三氧化硫的体积分数相同,故B错误;
C、温度相同,甲、乙、丙3个容器中反应的平衡常数相等,故C错误;
D、在上述条件下反应生成2molSO3(s),气体转化为固体放热,所以反应放热应大于197kJ,故D正确;
故选D.
点评 本题考查了等效平衡的建立判断,反应热的确定,平衡常数的比较依据,关键是相同条件下,三容器中达到相同平衡状态的判断.

练习册系列答案
相关题目
11.锂和钠两种元素相比较,正确的是( )
| A. | 锂的还原性比钠的弱 | B. | 锂原子的半径比钠的大 | ||
| C. | 锂的金属性比钠的强 | D. | 锂单质的熔点比钠的低 |
1.同温时,等物质的量浓度的下列溶液中,c(H+)最大的是( )
| A. | CH3COOH | B. | NaCl | C. | HCl | D. | Na2CO3 |
11.112号元素是上世纪末制造出来的新元素,其原子质量数为277.关于该元素的下列叙述正确的是( )
| A. | 该元素可能有放射性 | |
| B. | 该元素位于元素周期表中的第IIA族 | |
| C. | 其中子数与质子数之差为165 | |
| D. | 其原子质量是12C原子质量的277倍 |
15.现有下列九种物质:①H2 ②铝 ③Na2O ④CO2⑤H2SO4 ⑥Ba(OH)2固体 ⑦氨水⑧稀硝酸⑨熔融Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
(2)上述九种物质中有两种物质之间可发生离子反应:H++OH-═H2O,该离子反应对应的化学方程式为2HNO3+Ba(OH)2=Ba(NO3)2+2H2O.
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的还原剂与氧化剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6mol.
(1)按物质的分类方法填写表格的空白处:
| 分类标准 | 能导电 | 非电解质 | 电解质 |
| 属于该类的物质 | ②⑦⑧⑨ | ④ | ③⑤⑥⑨ |
(3)⑨在水中的电离方程式为Al2(SO4)3=2Al3++3SO42-.
(4)少量的④通入⑥的溶液中反应的离子方程式为:Ba2++2OH-+CO2=BaCO3↓+H2O.
(5)②与⑧发生反应的化学方程式为:Al+4HNO3═Al(NO3)3+NO↑+2H2O,该反应的还原剂与氧化剂的物质的量之比是1:1,当有5.4g Al发生反应时,转移电子的物质的量为0.6mol.
16.下列叙述中,不正确的是( )
| A. | 塑料,合成纤维和合成橡胶都是合成材料 | |
| B. | 煤是由有机物和无机物组成的复杂混合物 | |
| C. | 聚乙烯是通过聚反应制得的高分子化合物 | |
| D. | 钠,铝与铁通常都是采用电解法冶铁的 |
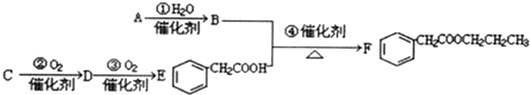
 .
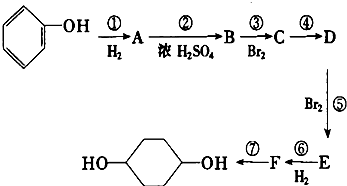
.
 、D
、D .
.
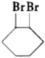 +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$ .
.