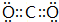题目内容
25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是△H=-393.5kJ/mol、△H=-285.8kJ/mol、△H=-890.3kJ/mol、△H=-2800kJ/mol,则下列热化学方程式正确的是( )
A、C(s)+
| ||
| B、2H2(g)+O2(g)?2H2O(l)△H=-571.6 kJ/mol | ||
| C、CH4(g)+2O2(g)?CO2(g)+2H2O(g)△H=-890.3 kJ/mol | ||
D、
|
分析:燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量,依据概念分析判断.
解答:解:A、反应中生成的一氧化碳不是最稳定氧化物,故A错误;
B、氢气燃烧最稳定的产物是液态水,并且燃烧是放热反应,符合燃烧热的含义,故B正确;
C、甲烷燃烧生成物气体水不是稳定氧化物,故C错误;
D、燃烧生成物气体水不是稳定氧化物,不符合燃烧热的概念,故D错误;
故选:B.
B、氢气燃烧最稳定的产物是液态水,并且燃烧是放热反应,符合燃烧热的含义,故B正确;
C、甲烷燃烧生成物气体水不是稳定氧化物,故C错误;
D、燃烧生成物气体水不是稳定氧化物,不符合燃烧热的概念,故D错误;
故选:B.
点评:本题考查热化学方程式的书写,注意反应物、生成物的状态与反应热的关系是关键,难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
下列说法中正确的是( )
| A、同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照条件下和点燃条件下的△H不同 | B、常温下,2A(s)+B(g)=2C(g)+D(g)不能自发进行,则该反应焓变一定大于零 | C、1mol硫酸与1mol Ba(OH)2完全中和所放出的热量为中和热 | D、在25℃、101KPa时,2mol S的燃烧热是1mol S的2倍 |
 试回答:
试回答: