��Ŀ����
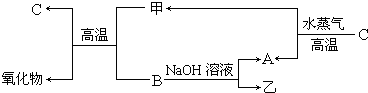
A��B��C�����ֳ���������Ԫ�صĵ��ʣ�������DΪ��ɫҺ�壬E��һ�ֳ������������壮��ת����ϵ��ͼ����Ӧ�����Ͳ��ֲ�����ȥ���� �Իش�
�Իش�
��1��E�ĵ���ʽ��
 ��
��
��2������X��B��D���ܷ�Ӧ���ɺ�ɫ���Թ���Y��Y�Ļ�ѧʽ��
��3������Z�����ڶԿ�������ɱ����������ˮ�����ʵȣ�Z��B�����Ԫ����ͬ��Z�����и�ԭ������������֮��Ϊ18��Z�����Ե⻯����Һ��Ӧ����B�͵ⵥ�ʣ���Ӧ�����ӷ���ʽ��
��4��ȡ0.3mol F������D��ֻ�Ϻ�������Һ����ͨ��0.2mol E��ַ�Ӧ�����õ���ˮ��Һ�и������ӵ�Ũ���ɴ�С��˳���ǣ�������H+��
��5��E�Ĵ����ŷŻ������ܶ�����⣮�п�ѧ���������E��H2�ϳ�CH3OH��H2O����E�����ۺ����ã�25�棬101kPaʱ���÷�Ӧ���Ȼ�ѧ����ʽ��
 �Իش�
�Իش���1��E�ĵ���ʽ��


��2������X��B��D���ܷ�Ӧ���ɺ�ɫ���Թ���Y��Y�Ļ�ѧʽ��
Fe3O4
Fe3O4
����3������Z�����ڶԿ�������ɱ����������ˮ�����ʵȣ�Z��B�����Ԫ����ͬ��Z�����и�ԭ������������֮��Ϊ18��Z�����Ե⻯����Һ��Ӧ����B�͵ⵥ�ʣ���Ӧ�����ӷ���ʽ��
O3+2H++2I-=O2+I2+H2O
O3+2H++2I-=O2+I2+H2O
����4��ȡ0.3mol F������D��ֻ�Ϻ�������Һ����ͨ��0.2mol E��ַ�Ӧ�����õ���ˮ��Һ�и������ӵ�Ũ���ɴ�С��˳���ǣ�������H+��
c��Na+����c��OH-����c��CO32-����c��HCO3-��
c��Na+����c��OH-����c��CO32-����c��HCO3-��
����5��E�Ĵ����ŷŻ������ܶ�����⣮�п�ѧ���������E��H2�ϳ�CH3OH��H2O����E�����ۺ����ã�25�棬101kPaʱ���÷�Ӧ���Ȼ�ѧ����ʽ��
CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol
CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol
������֪�״���ȼ���ȡ�H=-726.5kJ?mol-1��������ȼ���ȡ�H=-285.8kJ?mol-1��������A��B��C�����ֳ���������Ԫ�صĵ��ʣ�������DΪ��ɫҺ�壬ӦΪH2O��E��һ�ֳ������������壬ӦΪCO2����AΪH2��BΪO2��CΪ̼���ʣ�FΪNa2O2��
��1��CO2������̼ԭ������ԭ��֮���γ�2�Թ��õ��Ӷԣ�
��2������X��B��D���ܷ�Ӧ���ɺ�ɫ���Թ���Y����XΪFe��YΪ������������
��3��Z��B�����Ԫ����ͬ��Z�����и�ԭ������������֮��Ϊ18����ZӦΪO3����KI��Ӧ����O2��I2��
��4��0.3molNa2O2������ˮ��Ӧ����NaOH0.6mol����0.2molCO2��Ӧ�������ʵ���֮��Ϊ3��1��������ӦCO2+2NaOH=Na2CO3+H2O��ʣ��0.2molNaOH������0.2molNa2CO3����Һ�ʼ��ԣ�����Һ��CO32-ˮ������HCO3-���ݴ˽��
��5�����ݼ״���������ȼ���ȣ���д��ȼ�յ��Ȼ�ѧ����ʽ���ٸ��ݸ�˹����д��������̼�������ϳɼ״���ˮ���Ȼ�ѧ����ʽ����ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ䣮
��1��CO2������̼ԭ������ԭ��֮���γ�2�Թ��õ��Ӷԣ�
��2������X��B��D���ܷ�Ӧ���ɺ�ɫ���Թ���Y����XΪFe��YΪ������������
��3��Z��B�����Ԫ����ͬ��Z�����и�ԭ������������֮��Ϊ18����ZӦΪO3����KI��Ӧ����O2��I2��
��4��0.3molNa2O2������ˮ��Ӧ����NaOH0.6mol����0.2molCO2��Ӧ�������ʵ���֮��Ϊ3��1��������ӦCO2+2NaOH=Na2CO3+H2O��ʣ��0.2molNaOH������0.2molNa2CO3����Һ�ʼ��ԣ�����Һ��CO32-ˮ������HCO3-���ݴ˽��
��5�����ݼ״���������ȼ���ȣ���д��ȼ�յ��Ȼ�ѧ����ʽ���ٸ��ݸ�˹����д��������̼�������ϳɼ״���ˮ���Ȼ�ѧ����ʽ����ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ䣮
����⣺A��B��C�����ֳ���������Ԫ�صĵ��ʣ�������DΪ��ɫҺ�壬ӦΪH2O��E��һ�ֳ������������壬ӦΪCO2����AΪH2��BΪO2��CΪ̼���ʣ�FΪNa2O2��
��1��CO2������̼ԭ������ԭ��֮���γ�2�Թ��õ��Ӷԣ������ʽΪ ��
��
�ʴ�Ϊ�� ��
��
��2������X��B��D���ܷ�Ӧ���ɺ�ɫ���Թ���Y����XΪFe��YΪ��������������ѧʽΪFe3O4��
�ʴ�Ϊ��Fe3O4��
��3��Z��B�����Ԫ����ͬ��Z�����и�ԭ������������֮��Ϊ18����ZӦΪO3����KI��Ӧ����O2��I2����Ӧ���ӷ���ʽΪ��O3+2H++2I-=O2+I2+H2O��
�ʴ�Ϊ��O3+2H++2I-=O2+I2+H2O��
��4��0.3molNa2O2������ˮ��Ӧ����NaOH0.6mol����0.2molCO2��Ӧ�������ʵ���֮��Ϊ3��1��������ӦCO2+2NaOH=Na2CO3+H2O��ʣ��0.2molNaOH������0.2molNa2CO3����Һ�ʼ��ԣ�����Һ��CO32-ˮ������HCO3-��c��OH-����c��CO32-����c��HCO3-������Һ��c��Na+�������Һ������Ũ��c��Na+����c��OH-����c��CO32-����c��HCO3-����
�ʴ�Ϊ��c��Na+����c��OH-����c��CO32-����c��HCO3-����
��5���״���ȼ���ȡ�H=-726.5kJ?mol-1���ɵü״�ȼ�յ��Ȼ�ѧ����ʽ����CH3OH��l��+
O2��g���TCO2��g��+2H2O��l����H=-726.5 kJ?mol-1��
������ȼ���ȡ�H=-285.8kJ?mol-1���ɵ�����ȼ�յ��Ȼ�ѧ����ʽ����H2��g��+
O2��g���TH2O��l����H=-285.8 kJ?mol-1��
���ݸ�˹���ɣ��ڡ�3-�ٵã�CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol��
�ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol��
��1��CO2������̼ԭ������ԭ��֮���γ�2�Թ��õ��Ӷԣ������ʽΪ
 ��
���ʴ�Ϊ��
 ��
����2������X��B��D���ܷ�Ӧ���ɺ�ɫ���Թ���Y����XΪFe��YΪ��������������ѧʽΪFe3O4��
�ʴ�Ϊ��Fe3O4��
��3��Z��B�����Ԫ����ͬ��Z�����и�ԭ������������֮��Ϊ18����ZӦΪO3����KI��Ӧ����O2��I2����Ӧ���ӷ���ʽΪ��O3+2H++2I-=O2+I2+H2O��
�ʴ�Ϊ��O3+2H++2I-=O2+I2+H2O��
��4��0.3molNa2O2������ˮ��Ӧ����NaOH0.6mol����0.2molCO2��Ӧ�������ʵ���֮��Ϊ3��1��������ӦCO2+2NaOH=Na2CO3+H2O��ʣ��0.2molNaOH������0.2molNa2CO3����Һ�ʼ��ԣ�����Һ��CO32-ˮ������HCO3-��c��OH-����c��CO32-����c��HCO3-������Һ��c��Na+�������Һ������Ũ��c��Na+����c��OH-����c��CO32-����c��HCO3-����
�ʴ�Ϊ��c��Na+����c��OH-����c��CO32-����c��HCO3-����
��5���״���ȼ���ȡ�H=-726.5kJ?mol-1���ɵü״�ȼ�յ��Ȼ�ѧ����ʽ����CH3OH��l��+
| 3 |
| 2 |
������ȼ���ȡ�H=-285.8kJ?mol-1���ɵ�����ȼ�յ��Ȼ�ѧ����ʽ����H2��g��+
| 1 |
| 2 |
���ݸ�˹���ɣ��ڡ�3-�ٵã�CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol��
�ʴ�Ϊ��CO2��g��+3H2��g��=CH3OH��l��+H2O��1����H=-130.9kJ/mol��
���������⿼�������ƶϡ����û�ѧ�������Ũ�ȴ�С�ıȽϡ��Ȼ�ѧ����ʽ��д�ȣ���Ŀ�Ƚ��ۺϣ��ƶ������ǹؼ���ע���������Ũ�ȴ�С�ıȽϷ������Ѷ��еȣ�

��ϰ��ϵ�д�
�����Ŀ


 �ס��ҡ������ֳ������ʣ�A��B��C�����ֳ����Ļ����AΪ����ɫ���壻����֮���ת����ϵ��ͼ��ʾ������д���пհף�
�ס��ҡ������ֳ������ʣ�A��B��C�����ֳ����Ļ����AΪ����ɫ���壻����֮���ת����ϵ��ͼ��ʾ������д���пհף�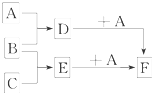 ��֪A��B��C�����ֳ����ĵ��ʣ�����AΪ���壬B��CΪ���壻D�ı�����Һ�����ˮ�м�����У���Һ�ʺ��ɫ��B��C��Ӧʱ�ɹ۲쵽��ɫ���棬����K������ˮ����ɫ��ҺE������֮��ת����ϵ��ͼ��ʾ��
��֪A��B��C�����ֳ����ĵ��ʣ�����AΪ���壬B��CΪ���壻D�ı�����Һ�����ˮ�м�����У���Һ�ʺ��ɫ��B��C��Ӧʱ�ɹ۲쵽��ɫ���棬����K������ˮ����ɫ��ҺE������֮��ת����ϵ��ͼ��ʾ��