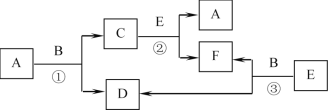
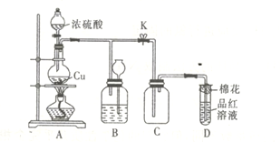
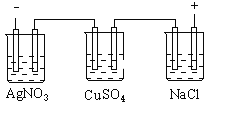
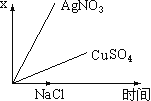
题目内容
【题目】病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如右图所示。利用标签所提供的信息,回答下列问题:

(1)该注射液中葡萄糖的质量分数为___________;
(2)该注射液中葡萄糖的物质的量浓度为__________。(保留两位小数)
(3)检测人的血液中葡萄糖(简称血糖,相对分子质量为180)的含量,参考指标常以两种计量单位表示,即“mmol/L”和“mg/dL”(1L=10dL)。以“mmol/L”表示时,人的血糖正常值在3.61~6.11 mmol/L之间。如果以“mg/dL”表示,血糖正常值范围是__________。
【答案】5% 0.28mol/L 64.98~109.98
【解析】
(1)由标签所提供的信息可知该注射液中葡萄糖的质量分数;
(2)由信息可知溶质的质量,n= ![]() 、c=
、c= ![]() 来计算该注射液中葡萄糖的物质的量浓度;
来计算该注射液中葡萄糖的物质的量浓度;
(3)以“mmol/L”表示时人的血糖正常值在3.61~6.11mmol/L之间,由1L=10dL,m=n×M来计算以“mg/dL”表示的血糖正常值范围。
(1)由标签所提供的信息可知该注射液中葡萄糖的质量分数为5%,故答案为5%;
(2)溶质的质量为25g,n=![]() =0.139mol,则c=
=0.139mol,则c=![]() =0.28mol/L,故答案为0.28mol/L;
=0.28mol/L,故答案为0.28mol/L;
(3)以“mmol/L”表示时人的血糖正常值在3.61~6.11mmol/L之间,则以“mg/dL”表示的血糖正常值范围为![]() ~
~![]() ,即为64.98~109.98,故答案为64.98~109.98。
,即为64.98~109.98,故答案为64.98~109.98。

 名校课堂系列答案
名校课堂系列答案【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
(1)取冰醋酸配制250 mL 0.4 mol·L-1的醋酸溶液,用0.4 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示。则稀释过程中溶液的pH由大到小的顺序______(填字母)。

②配制250 mL 0.4 mol·L-1 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、胶头滴管和____________。
③为标定该醋酸溶液的准确浓度,用0.2000 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_______________(多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度( mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是______________________________________________________________。
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法___________。
③利用水解理论设计实验证明醋酸的酸性比碳酸的强:______________________。
【题目】下表是元素周期表的一部分:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | A | |||||||
2 | D | E | G | I | ||||
3 | B | C | F | H |
(1)从原子结构角度分析,D、E、G、I四种元素处于同一行,是由于它们的_______相同。E和F元素在周期表处于同一列是由于它们的______相同。
(2)E元素的最低化合价为___________,原子半径:r(E)_________ r(D)![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() ,离子半径:r(G)_________ r(C)(填“
,离子半径:r(G)_________ r(C)(填“![]() ”、“
”、“![]() ”或“
”或“![]() ”)。
”)。
(3)在表中所列元素中最高价氧化物对应水化物中酸性最强的是________(写化学式)。
(4)科学家通过对某些元素的化合物进行研究,寻找高效农药。这些元素往往位于元素周期表的 _____________(选填序号)。
a.左下角区域 b.右上角区域 c.左上角区域 d.右下角区域