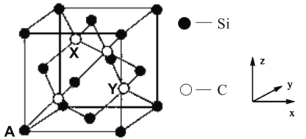
题目内容
【题目】利用反应Cu+2FeCl3=CuCl2+2FeCl2,设计一个原电池。
(1)选用____为负极,___为正极,电解质溶液为_____。
(2)写出电极反应式:负极_____,正极_____。
(3)画出装置图: ______
【答案】铜 石墨(或铂等) FeCl3溶液 Cu-2e-=Cu2+ 2Fe3++2e-=2Fe2+ 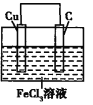
【解析】
由方程式可知,Cu被氧化,为原电池的负极,则正极可为碳棒或铂等,电解质溶液为氯化铁溶液,负极电极反应式为:Cu-2e-=Cu2+;正极电极反应式为:2Fe3++2e-=2Fe2+。
(1)由方程式可知,Cu被氧化,作为还原剂,为负极;Fe3+被还原,作为氧化剂,为正极,电解质溶液为氯化铁溶液;
(2)负极电极反应式为:Cu-2e-=Cu2+;正极电极反应式为:2Fe3++2e-=2Fe2+;
(3)装置图为 。
。

 阅读快车系列答案
阅读快车系列答案【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究。
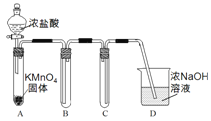
Ⅰ.用高锰酸钾和浓盐酸反应制取氯气
(1)该小组利用右图装置及试剂制备并收集适量Cl2,装置B、C的作用分别是___________、_______________。
(2)制得的氯气中加入适量水,得到饱和氯水,饱和氯水中含氯元素的微粒有____________(写出全部微粒)。
(3)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强。
①滤液漂白性增强的原因是________________(用化学平衡移动原理解释)。
②饱和氯水与石灰石反应生成HC1O的方程式是___________________。
Ⅱ. ClO3—、Cl—和H+反应的探究
(4)KClO3、KCl与硫酸可以反应。该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | (____)mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的_______________________。
②烧杯3取用硫酸的体积应为______________mL。
(5)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2______________________。