题目内容
【题目】I.某学习小组做Na2O2与H2O反应的实验,发现一些有趣的现象:
①取适量Na2O2固体用脱脂棉包好放在石棉网上,然后向脱脂棉上滴加3-4滴水,结果脱脂棉剧烈燃烧。
②取适量Na2O2固体置于试管中,加水使其充分反应至不再产生气体为止,滴入几滴酚酞试液,溶液先变红后褪色。回答有关问题。
(1)写出Na2O2的电子式_______________________。
(2)已知Na2O2可看作二元弱酸H2O2对应的盐,其第一步水解完全进行。写出其第一步水解的离子方程式为___________________________________。
(3)由①实验现象所得出的有关结论是:a.有氧气生成;b.___________________。
(4)Na2O2与H2O反应的离子方程式____________________________________。
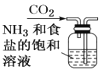
II.为探究Na2O2与H2O反应的机理,他们在老师的指导下设计了下图所示装置。连接好装置,打开K1、K2,通过注射器注入适量蒸馏水,充分反应后用气球鼓气,Na2S溶液变浑浊,酸性KMnO4溶液褪色。分别取A、C中溶液滴入几滴酚酞,开始都变红,以后A中溶液很快褪色,C中溶液缓慢褪色。另取A、C中溶液分别加入少量二氧化锰,充分振荡,发现均反应剧烈、产生大量气泡,把带火星的木条伸入试管,木条复燃,向反应后的溶液中滴入几滴酚酞试液,溶液变红不褪色。

(5)A中冰盐和C中热水的作用分别是__________________,___________________。
(6)用化学方程式表示Na2S变浑浊的原因___________________________________。
(7)用离子方程式表示KMnO4溶液褪色的原因(MnO4-在酸性条件下被还原成Mn2+)__________________________________________。
(8)Na2O2与H2O反应的机理是(用化学方程式表示)第一步_____________________,第二步_______________________________。
(9)若向Na2O2中滴加适量的稀盐酸,也能产生同样的气体,请写出该反应的化学方程式___________________________________。
【答案】 ![]() Na2O2+H2O=2Na++HO2-+OH- 反应放热 2Na2O2+2H2O=4Na++4OH-+O2↑ 防止生成的H2O2分解 使H2O2分解 Na2S+H2O2=S↓+2NaOH 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O Na2O2+2H2O=2NaOH+H2O2 2H2O2=2H2O+O2↑ 2Na2O2+4HCl=4NaCl+2H2O+O2↑
Na2O2+H2O=2Na++HO2-+OH- 反应放热 2Na2O2+2H2O=4Na++4OH-+O2↑ 防止生成的H2O2分解 使H2O2分解 Na2S+H2O2=S↓+2NaOH 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O Na2O2+2H2O=2NaOH+H2O2 2H2O2=2H2O+O2↑ 2Na2O2+4HCl=4NaCl+2H2O+O2↑
【解析】I.(1)过氧化钠是离子化合物,电子式为![]() 。(2)已知Na2O2可看作二元弱酸H2O2对应的盐,其第一步水解完全进行,则其第一步水解的离子方程式为Na2O2+H2O=2Na++HO2-+OH-。(3)脱脂棉剧烈燃烧,说明反应中除了有氧气生成以外,反应还放热;(4)Na2O2与H2O反应生成氢氧化钠和氧气,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
。(2)已知Na2O2可看作二元弱酸H2O2对应的盐,其第一步水解完全进行,则其第一步水解的离子方程式为Na2O2+H2O=2Na++HO2-+OH-。(3)脱脂棉剧烈燃烧,说明反应中除了有氧气生成以外,反应还放热;(4)Na2O2与H2O反应生成氢氧化钠和氧气,反应的离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑。
II.充分反应后用气球鼓气,Na2S溶液变浑浊,说明有氧气生成,氧气氧化硫化钠生成单质硫变浑浊;酸性KMnO4溶液褪色,说明还有过氧化氢生成,高锰酸钾氧化过氧化氢而褪色。分别取A、C中溶液滴入几滴酚酞,开始都变红,说明有氢氧化钠生成,以后A中溶液很快褪色,C中溶液缓慢褪色。另取A、C中溶液分别加入少量二氧化锰,充分振荡,发现均反应剧烈、产生大量气泡,把带火星的木条伸入试管,木条复燃,进一步说明反应中还有过氧化氢生成,在催化剂的作用下分解生成水和氧气。
(5)双氧水不稳定,温度过高容易分解,则A中用冰盐冷浴,目的是防止温度过高时H2O2分解;C中用热水浴可使H2O2分解;(6)根据以上分析可知Na2S变浑浊的原因是Na2S+H2O2=S↓+2NaOH。(7)酸性高锰酸钾溶液具有强氧化性,H2O2使KMnO4溶液褪色,体现了双氧水的还原性,反应的离子方程式为2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O。(8)根据以上分析可知,过氧化钠与水反应的机理为:Na2O2与H2O反应生成H2O2,H2O2遇热分解生成氧气,反应方程式分别为Na2O2+2H2O=2NaOH+H2O2、2H2O2![]() 2H2O+O2↑。(9)Na2O2中滴加适量的盐酸,也能产生使带火星的木条复燃的气体,且最后溶液呈中性,过氧化钠和盐酸反应生成氯化钠、氧气和水,反应的化学方程式为2Na2O2+4HCl=4NaCl+2H2O+O2↑。
2H2O+O2↑。(9)Na2O2中滴加适量的盐酸,也能产生使带火星的木条复燃的气体,且最后溶液呈中性,过氧化钠和盐酸反应生成氯化钠、氧气和水,反应的化学方程式为2Na2O2+4HCl=4NaCl+2H2O+O2↑。

 天天向上口算本系列答案
天天向上口算本系列答案