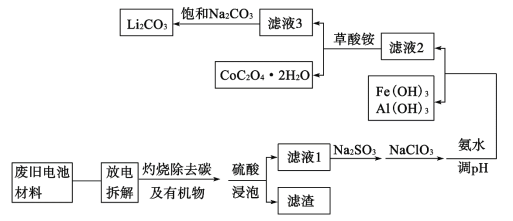
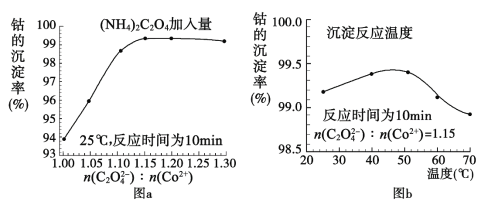
题目内容
【题目】COCl2(g)![]() CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) ΔH>0,当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A. ①④⑥B. ①②④C. ②③⑤D. ③⑤⑥
【答案】A
【解析】
①根据化学方程式可知,该反应是体积增大的、吸热的可逆反应,所以升高温度或降低压强,反应都是向正反应方向进行的,COCl2转化率增大,①符合题意;
②恒容通入惰性气体,浓度不变,平衡不移动,转化率不变。②不符合题意;
③增大CO的浓度,平衡向逆反应方向移动,转化率降低。③不符合题意
④减小压强,平衡向气体体积增大的方向移动,即正向移动,COCl2转化率增加,④符合题意;
⑤催化剂不能改变平衡状态,转化率不变。⑤不符合题意;
⑥恒压通入惰性气体,则容积增大,相当于减压平衡向正反应方向移动,COCl2转化率增大;⑥符合题意;
综上①④⑥符合题意,答案选A。

 智慧小复习系列答案
智慧小复习系列答案【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
(1)汽车尾气中常含有碳烟、CO、NO等有害物质,尾气中含有碳烟的主要原因为___。
(2)已知在298K和101kPa条件下,有如下反应:
反应①:C(s)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1
反应②:N2(g)+O2(g)=2NO(g) ΔH2=+180.5kJ·mol-1
若反应![]() CO2(g)+
CO2(g)+![]() N2(g)
N2(g)![]() C(s)+NO(g)的活化能为akJ·mol-1,则反应C(s)+2NO(g)CO2(g)+N2(g)的活化能为___kJ·mol-1。
C(s)+NO(g)的活化能为akJ·mol-1,则反应C(s)+2NO(g)CO2(g)+N2(g)的活化能为___kJ·mol-1。
(3)在常压下,已知反应2CO(g)+2NO(g)N2(g)+2CO2(g) ΔH(298K)=-113.0kJ·mol-1,ΔS(298K)=-145.3J/(mol·K),据此可判断该反应在常温下___(填“能”或“不能”)自发进行。
(4)向容积为2L的真空密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g),NO和N2的物质的量变化如表所示,在T1℃、T2℃分别到达平衡时容器的总压强分别为p1kPa、p2kPa。
物质的量/mol | T1℃ | T2℃ | |||||
0 | 5min | 10min | 15min | 20min | 25min | 30min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~10mi内,以NO表示的该反应速率v(NO)=___kPa·min-1。
②第15min后,温度调整到T2,数据变化如表所示,则p1___p2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2mol,再次达平衡时NO的体积百分含量为___。
(5)为探究温度及不同催化剂对反应2NO(g)+2CO(g)+N2(g)+2CO2(g)的影响,分别在不同温度、不同催化剂下,保持其它初始条件不变重复实验,在相同时间内测得NO转化率与温度的关系如图所示:
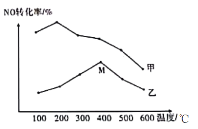
①在催化剂乙作用下,图中M点对应的速率(对应温度400℃)v正___v逆(填“>”、“<”或“=”),其理由为___。
②温度高于400℃,NO转化率降低的原因可能是___。