题目内容
【题目】治理大气和水体污染对建设美丽家乡,打造宜居环境具有重要意义。
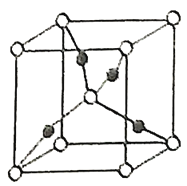
(1)CO泄漏会导致人体中毒,用于检测CO的传感器的工作原理如图所示:写出电极I上发生的反应式:__。

工作一段时间后溶液中H2SO4的浓度__(填“变大”、“变小”或“不变”)
(2)用O2氧化HCl制取Cl2,可提高效益,减少污染。反应为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) H,通过控制条件,分两步循环进行,可使HCl转化率接近100%,其原理如图所示:
2Cl2(g)+2H2O(g) H,通过控制条件,分两步循环进行,可使HCl转化率接近100%,其原理如图所示:

过程I的反应为:2HCl(g)+CuO(s)![]() CuCl2(s)+H2O(g) H1
CuCl2(s)+H2O(g) H1
过程II反应的热化学方程式(H2用含有H和H1的代数式表示)__。
(3)在温度T0℃,容积为1L的绝热容器中,充入0.2molNO2,发生反应:2NO2(g)![]() N2O4(g) H<0,容器中NO2的相关量随时间变化如图所示。
N2O4(g) H<0,容器中NO2的相关量随时间变化如图所示。

①反应到6s时,NO2的转化率是__。
②根据图示,以下各点表示反应达到平衡状态的是__。
a.X b.Y c.Z d.W
③0~3s内容器中NO2的反应速率增大,而3s后容器中NO2的反应速率减小了,原因是__。
④此容器中反应达平衡时,温度若为T1℃,此温度下的平衡常数K═__。
(4)工业上可用Na2SO3溶液吸收法处理SO2,25℃时用1molL-1的Na2SO3溶液吸收SO2,当溶液pH═7时,溶液中各离子浓度的大小关系为:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)═c(OH-)。(已知25℃时:H2SO3的电离常数Ka1═1.3×10-2,Ka2═6.2×10-8)请结合所学理论通过计算说明c(HSO3-)>c(SO32-)的原因___。
【答案】CO-2e-+H2O=CO2+2H+ 不变 2CuCl2(s)+O2(g)═2CuO(s)+2Cl2(g) H2═H-2H1 80% d 反应放热,体系的温度升高,反应速率加快,后来NO2浓度减小,反应速率随之减小 225 根据Ka2═c(SO32-)c(H+)/c(HSO3-)=6.2×10-8,将c(H+)═1.0×10-7代入得出c(SO32-)/c(HSO3-)═6.2×10-1<1,所以c(HSO3-)>c(SO32-)
【解析】
(1)根据图示可知电极I上CO失电子被氧化为CO2,电解质溶液为硫酸溶液,所以电极方程式为CO-2e-+H2O=CO2+2H+;电极Ⅱ上氧气被还原生成水,电极方程式为O2+4e-+4H+=2H2O,所以总反应为2CO+O2=2CO2,不影响硫酸的浓度,即硫酸的浓度不变;
(2)总反应为4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) H ①;
2Cl2(g)+2H2O(g) H ①;
过程I的反应为:2HCl(g)+CuO(s)![]() CuCl2(s)+H2O(g) H1 ②;
CuCl2(s)+H2O(g) H1 ②;
根据盖斯定律①-②×2可得过程II反应的热化学方程式为2CuCl2(s)+O2(g)=2CuO(s)+2Cl2(g) H2=H-2H1,因整个过程中HCl的转化率接近100%,所以过程II用“=”;
(3)①据图可知6s时,c(NO2)=0.05mol/L,初始c(NO2)=0.20mol/L,所以转化率为![]() =80%;
=80%;
②据图可知X、Y、Z三个点速率还在随时间发生改变,W点速率不在改变,所以W点可以表示反应达到平衡状态,所以选d;
③该反应放热,随反应进行体系内温度升高,反应速率加快,但后来NO2的浓度减小,浓度对反应速率的影响占主导,所以反应速率减慢;
④据图可知平衡时c(NO2)=0.02mol/L,则△c(NO2)=0.20mol-0.02mol/L=0.18mol/L,根据方程式可知平衡时c(N2O4)=0.09mol/L,所以平衡常数K=![]() =225;
=225;
(4)根据Ka2= =6.2×10-8,将c(H+)=1.0×10-7代入得出
=6.2×10-8,将c(H+)=1.0×10-7代入得出 =6.2×10-1<1,所以c(HSO3-)>c(SO32-)。
=6.2×10-1<1,所以c(HSO3-)>c(SO32-)。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
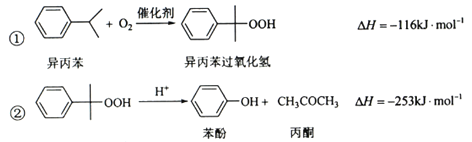
超能学典应用题题卡系列答案【题目】(化学——选修2:化学与技术)苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:

相关化合物的物理常数
物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
异丙苯 | 120 | 0.8640 | 153 |
丙酮 | 58 | 0.7898 | 56.5 |
苯酚 | 94 | 1.0722 | 182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_______________。
(4)反应②为 (填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)。
a. NaOH b. CaCO c. NaHCO d. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。