题目内容
13.三草酸合铁酸钾晶体(K2[Fe(C2O4)3]•xH2O)是一种光敏材料,在110℃可完全失去结晶水.为测定该晶体中铁的含量,某实验小组做了如下实验:步骤一:称量5.00g三草酸合铁酸钾晶体,配制成250ml溶液.
步骤二:取所配溶液25.00ml于锥形瓶中,加稀H2SO4酸化,滴加KMnO4溶液至草酸根恰好全部氧化成二氧化碳,同时,MnO4-被还原成Mn2+.向反应后的溶液中加入一小匙锌粉,加热至黄色刚好消失,过滤,洗涤,将过滤及洗涤所得溶液收集到锥形瓶中,此时,溶液仍呈酸性.
步骤三:用0.010mol/L KMnO4溶液滴定步骤二所得溶液至终点,消耗KMnO4溶液20.02ml,滴定中MnO4-,被还原成Mn2+.
重复步骤二、步骤三操作,滴定消耗0.010mol/L KMnO4溶液19.98ml
请回答下列问题:
(1)配制三草酸合铁酸钾溶液的操作步骤依次是:称量、溶解、转移、洗涤并转移、定容、摇匀.
(2)若配制三草酸合铁酸钾溶液时仰视定容,则所配溶液物质的量浓度偏低(选填“偏低”、“偏高”“不变”)
(3)加入锌粉的目的是将三价铁离子还原为二价铁离子.
(4)写出步骤三中发生反应的离子方程式MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O.
(5)计算实验测得该晶体中铁的质量分数(写出计算过程),在步骤二中,若加入的KMnO4的溶液的量不够,则测得的铁含量偏高.(选填“偏低”“偏高”“不变”)
分析 (1)根据配制一定物质的量浓度的溶液的操作步骤解答;
(2)仰视定容导致溶液的体积偏大,依据C=$\frac{n}{V}$进行误差分析;
(3)锌与三价铁反应生成二价铁离子和锌离子;
(4)高锰酸钾在酸性环境下能够氧化二价铁离子;
(5)根据离子方程式计算n(Fe2+),根据元素守恒,利用m=nM计算晶体中铁元素的质量,再根据质量分数定义计算;
加入的KMnO4的溶液的量不足,导致草酸根有剩余,再滴定亚铁离子时,进行与高锰酸钾反应,使的滴定亚铁离子消耗的高锰酸钾的体积偏大;
解答 解:(1)配制一定物质的量浓度的溶液的操作步骤:计算、称量、溶解、移液、洗涤、定容、摇匀;
所以缺少的步骤为:溶解;定容;
故答案为:溶解;定容;
(2)视定容导致溶液的体积偏大,依据C=$\frac{n}{V}$,可知溶液的浓度偏低;
故答案为:偏低;
(3)加入锌粉与三价铁离子反应生成二价铁离子,将三价铁离子还原为二价铁离子;
故答案为:将三价铁离子还原为二价铁离子;
(4)高锰酸钾在酸性环境下能够氧化二价铁离子,反应的离子方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
故答案为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
(5)消耗0.010mol/L KMnO4溶液19.98ml,依据方程式得:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.010mol/L×0.01998L
解得n(Fe2+)=0.000999mol,所以250ml溶液中亚铁离子物质的量为:0.00999mol;
铁的质量分数ω(Fe)=$\frac{0.00999mol×56g/mol}{5.00g}$×100%=11.2%;
加入的KMnO4的溶液的量不足,导致草酸根有剩余,再滴定亚铁离子时,进行与高锰酸钾反应,使的滴定亚铁离子消耗的高锰酸钾的体积偏大;
故答案为:11.2%;偏高;
点评 本题为综合题,考查了一定物质的量浓度溶液的配制,滴定法测量物质的含量,离子方程式的书写,明确实验原理是解题关键,注意准确判断反应物之间量的关系是解题关键,题目难度中等.

①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
| A. | 不一定有SO42-离子 | B. | 一定有CO32-离子 | ||
| C. | Cl-离子一定存在 | D. | 一定没有SO42-离子 |
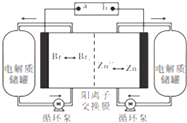 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环,下列说法正确的是( )| A. | 充电时电极a连接电源的负极 | |
| B. | 放电时负极的电极反应式为2Br--2e-═Br2 | |
| C. | 放电时左侧电解质储罐中的离子总浓度增大 | |
| D. | 充电时右侧电极变粗.电解质溶液浓度減小 |
| A. | X+Y?3Z(正反应吸热) | B. | 2X+Y?2Z(正反应吸热) | ||
| C. | X+Y?2Z(正反应吸热) | D. | X+2Y?4Z(正反应放热) |
Zn+2OH--2e-═ZnO+H2O;Ag2O+H2O+2e-═2Ag+2OH-,根据上述反应式,判断下列叙述中正确的是( )
| A. | 在使用过程中,电池负极区溶液的碱性增强 | |
| B. | 使用过程中,电子由Ag2O极经外电路流向Zn极 | |
| C. | Zn是负极,Ag2O是正极 | |
| D. | Zn电极发生还原反应,Ag2O电极发生氧化反应 |
| A. | 因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色 | |
| B. | 能使品红溶液褪色的气体不一定是SO2 | |
| C. | SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色,其原理相同 | |
| D. | 将SO2与Cl2混合后通入品红溶液中漂白效果更好 |
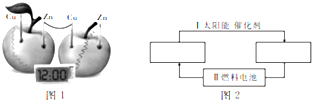 电化学知识可广泛应用于生产生活实际之中.
电化学知识可广泛应用于生产生活实际之中.
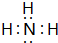 (或
(或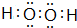
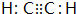 );
); 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体.