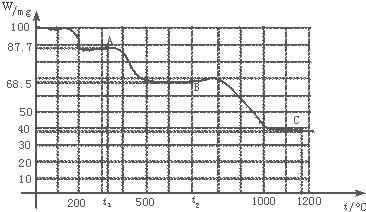
题目内容
【题目】在溶液中有浓度均为0.01molL﹣1的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:25℃时,Ksp[Fe(OH)3]=4.0×10﹣38;Ksp[Cr(OH)3]=7.0×10﹣31 , Ksp[Zn(OH)2]=1.0×10﹣17;Ksp[Mg(OH)2]=1.8×10﹣11 . 当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小( )
A.Fe3+
B.Cr3+
C.Zn2+
D.Mg2+
【答案】A
【解析】解:25℃时,Ksp[Fe(OH)3]=4.0×10﹣38;Ksp[Cr(OH)3]=7.0×10﹣31,Ksp[Zn(OH)2]=1.0×10﹣17;Ksp[Mg(OH)2]=1.8×10﹣11.
c(OH﹣)= ![]() =
= ![]() ≈1.587×10﹣12;
≈1.587×10﹣12;
c(OH﹣)= ![]() =
= ![]() ≈8.8×10﹣9;
≈8.8×10﹣9;
c(OH﹣)= ![]() =
= ![]() ≈3.2×10﹣7;
≈3.2×10﹣7;
c(OH﹣)= ![]() =
= ![]() ≈4.24×10﹣4;
≈4.24×10﹣4;
c(OH﹣)越小,沉淀需要的pH越小,
故选A.

【题目】(1)固体可分为晶体、非晶体和准晶体三大类,可通过________________方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。基态Mn原子的电子排布式为_______________。
(2)PCl3的立体构型为______________,中心原子的杂化轨道类型_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF3 | BCl3 | BBr3 | BI3 | |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是___________________。
②B、C、N、O三种元素第一电离能由小到大的顺序为___________。
③用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:____________。
(4)碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
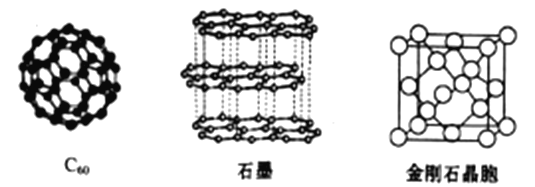
回答下列问题
①石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm,其原因是金刚石中只存在C-C间的________共价键,而石墨层内的C-C间存在_________键。
②金刚石晶胞含有___________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,列式表示碳原子在晶胞中的空间占有率__________(不要求计算结果)。