题目内容
【题目】2017年我国承建全球首艘深海采矿船,具2500米深海作业能力,对未来深海矿产资源的开发具有重要战略价值。海洋深处有丰富的锰结核矿(主要成分为MnO2,含少量Fe、Al等杂质元素),利用锰结核矿可以制备高纯碳酸锰,请回答下列有关问题:
(1)写出用MnO2和浓盐酸制取氯气的化学方程式________________。
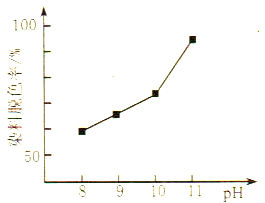
(2)MnO2与过氧化氢的反应十分复杂。在酸性条件下,MnO2可以被H2O2还原成Mn2+,但H2O2又有氧化性,有研究表明,H2O2溶液的氧化性是HO2-所致。其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如图所示:
①写出MnO2在酸性条件下与H2O2反应的离子方程式____________。
②由图可得到的结论是_________,结合平衡移动原理简述理由:__________。
(3)利用锰结核矿在实验室制备高纯碳酸锰的流程如下:
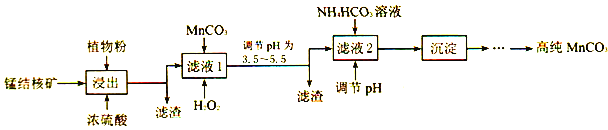
①可用SO2代替植物粉,植物粉的作用是___________。
②使用碳酸锰调pH的优势是___________。
③加入NH4HCO3时,温度要控制在35℃以下,其目的是___________。
(4)在废水处理中常用H2S将Mn2+转化为MnS除去,向含有0.020mo/LMn2+的废水中通入一定量的H2S气体,调节溶液的pH,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则此时溶液的pH=______。[已知:Ksp(MnS)=1.4×10-15;H2S的电离常数K1=1.3×10-7,K2=7.0×10-15]
【答案】 MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O MnO2+2H++H2O2=Mn2++2H2O+O2↑ 其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好 pH增大,c(OH-)增大,促使H2O2===HO2-+H+正向移动,c(HO2-)增大,漂白效果越好 作还原剂 不引入新杂质 减少碳酸玺被分解,提高原料利用率 5
【解析】(1)MnO2和浓盐酸加热反应得到氯化锰、氯气和水,化学方程式MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O;正确答案:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O。
(2)①根据题给信息可知MnO2在酸性条件下与H2O2反应,MnO2被还原为锰离子,H2O2被氧化为氧气,反应的离子方程式:MnO2+2H++H2O2=Mn2++2H2O+O2↑;正确答案:MnO2+2H++H2O2=Mn2++2H2O+O2↑。
②根据图像可知:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;原因:pH增大,c(OH-)增大,促使H2O2![]() HO2-+H+正向移动,c(HO2-)增大,漂白效果越好;正确答案:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;pH增大,c(OH-)增大,促使H2O2
HO2-+H+正向移动,c(HO2-)增大,漂白效果越好;正确答案:其他条件相同时,初始pH越大染料脱色率越高,即H2O2的漂白效果越好;pH增大,c(OH-)增大,促使H2O2![]() HO2-+H+正向移动,c(HO2-)增大,漂白效果越好。
HO2-+H+正向移动,c(HO2-)增大,漂白效果越好。
(3) ①根据流程可知,二氧化锰中+4价锰变为碳酸锰中+2价锰,发生还原反应,植物粉起到还原剂的作用,可用SO2代替植物粉,植物粉的作用是作还原剂,正确答案:作还原剂。
②碳酸锰不溶于水,能够与酸反应,调节溶液的pH,不引入新的杂质;正确答案:不引入新的杂质。
③NH4HCO3在温度较高时,易发生分解,因此在加入NH4HCO3时,温度要控制在35℃以下,减少碳酸氢铵的分解,提高原料利用率;正确答案:减少碳酸氢铵的分解,提高原料利用率。
(4) Mn2+开始沉淀时溶液中硫离子浓度是1.4×1015÷0.020 mol·L1=7.0×1014 mol/L,根据K2=7.0×1015,可知溶液中氢离子浓度是![]() ,所以pH=5;正确答案:5。
,所以pH=5;正确答案:5。