题目内容
【题目】Na2O2可用作制氧剂、漂白剂。
(1)已知:2CrO42ˉ+2H+![]() Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
Cr2O72ˉ+H2O。在碱性溶液中,Na2O2可以把Cr2(SO4)3中的Cr元素氧化成+6价,该反应的离子方程式为___________________________________。
(2)某化学兴趣小组同学欲在实验室中制备少量Na2O2。
查阅资料得知,将钠加热至熔化,通入一定量的除去CO2的空气,维持温度在453—473K之间,钠即被氧化为Na2O;进而增加空气流量并迅速提高温度至573—673K,即可制得Na2O2。
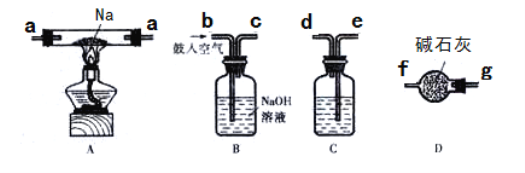
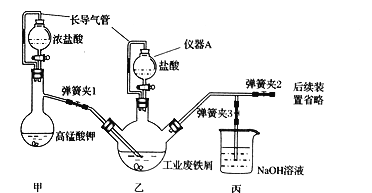
①若采用上述仪器装置制备Na2O2,从左到右仪器的连接顺序为(填接口字母,各装置只能用一次)________;装置D的作用为________。
②装置A中生成Na2O2的化学反应方程式为_______________________。
③若实验时准确称取2.3 gNa进行反应,将反应后的固体溶于1L水中,向所得溶液中加入50 mL 0.5 mol/L NH4Al(SO4)2溶液充分反应,请写出加入NH4A1(SO4)2溶液后发生反应的离子方程式________。
(3)小组同学继续对反应后固体的组成进行探究。
a.取一定量反应后固体,加入足量水充分反应,有气体生成;
b.将生成的气体全部转入真空密闭容器中,放电后充分反应,气体体积减少了3 / 5(不考虑O3的生成)。
①反应后固体中一定有的物质为________(填化学式)。
②为进一步确定反应后固体的组成,需对b中剩余气体继续进行猜想与设计,请完成下表。
猜想 | 实验设计 | 现象与结论 |
剩余气体为___________。 | _______________________________。 | 若看到____________ 证明此猜想正确,反之则不正确 |
【答案】 3Na2O2+2Cr3++4OH-=6Na++2CrO42-+2H2O bcedaagf 防止空气中的CO2和H2O进入A装置 2Na2O +O2==2Na2O2 NH4++Al3++4OH-=NH3H2O+Al(OH)3↓ Na、Na2O2 H2或O2 将b中剩余气体通过灼热的氧化铜或将b中剩余气体通过灼热的铜网 黑色固体变红或红色固体变黑
【解析】(1). CrO42ˉ中Cr元素呈+6价,而Cr2O72ˉ中Cr元素呈+3价,在碱性条件下,反应物中要加入OH-,所以离子方程式为:3Na2O2+2Cr3++4OH-=6Na++2CrO42-+2H2O;
(2). ①首先将空气通入B中出去二氧化碳,再用C装置除去气体中水分,最后在装置的尾端加装D防止空气中二氧化碳和水分进入,故连接顺序为:bcedaagf;②首先生成了氧化钠,再由氧化钠作为反应物生成过氧化钠:2Na2O +O2==2Na2O2;③2.3g钠可生成0.1molNaOH,从而有0.1molOH-参加反应,0.025molNH4Al(SO4)2将电离出0.25mol及0.75mol,恰好完全反应,故离子反应方程式为:NH4++Al3++4OH-=NH3H2O+Al(OH)3↓;
(3). ①在真空中放电后能发生反应,气体中含有氢气和氧气,则固体中含有Na和Na2O2,与水反应可生成氢气和氧气;②气体为反应完全,所以剩余气体为H2或O2;试验设计可检测两种气体的任意一种,将b中剩余气体通过灼热的氧化铜或将b中剩余气体通过灼热的铜网是分别对氢气和氧气的检测,其结果若为黑色固体变红或红色固体变黑证明此猜想正确反之则不正确。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)写出溶液④中通少量CO2的离子方程式:_________________________.
(2)25℃时,溶液①中,由水电离产生的c(OH﹣)=_____molL﹣1。
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=____________.(用ab表示)