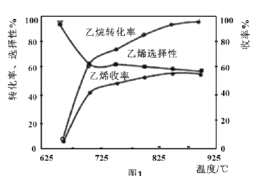
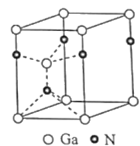
题目内容
【题目】在200mL5mol/L稀硝酸中加入19.2g铜粉,待充分反应,判断下列说法正确的是(忽略反应前后溶液体积的变化)( )
A.反应中转移电子的物质的量为0.6NA
B.标准状况下,产生NO2气体的体积为4.48L
C.反应后,H+的物质的量浓度为1.0mol/L
D.被还原的HNO3的物质的量为0.6mol
【答案】C
【解析】
铜的物质的量n=![]() =0.3mol,硝酸的物质的量n=cV=0.2L×5mol/L=1mol,据铜与硝酸反应的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,铜不足,故转移电子数、反应消耗的硝酸的量、被还原的硝酸的量,均利用铜计算。
=0.3mol,硝酸的物质的量n=cV=0.2L×5mol/L=1mol,据铜与硝酸反应的化学方程式3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O可知,铜不足,故转移电子数、反应消耗的硝酸的量、被还原的硝酸的量,均利用铜计算。
A.1mol的铜转移2mol的电子,0.3mol的铜转移0.6mol的电子,故A项错误;
B.铜与稀硝酸反应产生NO气体,故B项错误;
C.根据方程式0.3mol铜消耗0.8mol的硝酸,剩余硝酸0.2mol,剩余硝酸的物质的量浓度为c=![]() =
=![]() =1mol/L,H+的物质的量浓度为1.0mol/L,故C项正确;
=1mol/L,H+的物质的量浓度为1.0mol/L,故C项正确;
D.根据方程式8mol硝酸中只有2mol参与氧化还原反应,故0.8mol硝酸参加反应,被还原的HNO3的物质的量为0.2mol,故D项错误;
答案为C。

【题目】下表列出了①~111种元素在元素周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |||
一 | ① | ||||||||||
二 | ② | ③ | ④ | ⑤ | |||||||
三 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ||||||
四 | |||||||||||
请按要求回答下列问题:
(1)写出元素③形成单质的电子式______________
(2)画这11种元素中,非金属性最强的元素的原子结构示意图________________
(3)元素⑤④⑩分别和①形成的气体化合物中,最稳定的是(填化合物的化学式)__________
(4)元素⑨⑩的最高价氧化物的水化物中,酸性最强的是(填化合物的化学式)___________
(5)在盛有水的小烧杯中加入元素⑩的单质,发生反应的离子方程式____________________
(6)请从原子结构的角度解释,解释元素⑩的非金属性比元素强的原因_______________________