题目内容
【题目】氮气、羟基乙胺(HOCH2CH2NH2)和氮化镓都含氮元素,其用途非常广泛。回答下列问题:
(1)基态氮原子价层电子排布图为___,其中电子能量最高的能级是___。
(2)HOCH2CH2NH2所含非金属元素电负性由大到小顺序为___,其中C和N的杂化方式均为___HOCH2CH2NH2中∠HOC小于∠HNC,其原因是___。
(3)HOCH2CH2NH2是一种常见的二齿配体,能和Co2+形成环状配离子。Co位于元素周期表中___区,该环状配离子的配位原子为___。
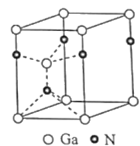
(4)氮化镓为六方晶胞,其结构如图,其中Ga作六方最密堆积。Ga填充在N围成的___(选填:八面体空隙、正四面体空隙、立方体空隙或三角形空隙);已知该晶胞底边边长为apm,高为cpm,阿伏加德罗常数的值为NA,则该晶体的密度为___gcm-3(列出计算式即可)。
【答案】![]() 2p O>N>C>H sp3 O有两对孤电子对,而N只有一对孤电子对,O的孤电子对对成键电子对斥力更大所致 d N和O 正四面体空隙
2p O>N>C>H sp3 O有两对孤电子对,而N只有一对孤电子对,O的孤电子对对成键电子对斥力更大所致 d N和O 正四面体空隙 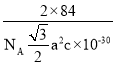
【解析】
(1)氮是7号元素,价电子是5,电子排布图为![]() ,电子的能级有1s、2s、2p,能量由低到高为1s<2s<2p,电子能量最高的能级是2p。
,电子的能级有1s、2s、2p,能量由低到高为1s<2s<2p,电子能量最高的能级是2p。
(2)HOCH2CH2NH2所含非金属元素有H、O、C、N,同周期从左到右,电负性逐渐增大,有O>N>C,同主族从上到下,电负性逐渐减小,H的电负性最小,所以由大到小顺序为O>N>C>H;其中C形成4条σ键,无孤电子对,采取sp3杂化类型;N形成3条σ键,有一对孤电子对,采取sp3杂化类型,所以C和N的杂化方式均为sp3;HOCH2CH2NH2中O有两对孤电子对,而N只有一对孤电子对,O的孤电子对对成键电子对斥力更大导致∠HOC小于∠HNC。
(3)Co在元素周期表中第四周期,第Ⅷ族,所以在周期表d区;HOCH2CH2NH2是中只有N和O存在孤电子对,能提供电子对给Co2+,形成配位键,所以配位原子为N和O。
(4)氮化镓为六方晶胞,根据图可知,Ga周围有四个原子,所以围成的是正四面体空隙;根据均摊法可知,该晶胞中含有Ga:![]() ,含有N:
,含有N:![]() ,由于为六方晶胞,所以底面边长为a,其中一个角为60°的菱形,可得其高为
,由于为六方晶胞,所以底面边长为a,其中一个角为60°的菱形,可得其高为![]() apm ,底面面积为
apm ,底面面积为![]() a2pm2,晶胞体积为
a2pm2,晶胞体积为![]() a2c pm3=
a2c pm3=![]() a2c×10-30cm3,则密度为
a2c×10-30cm3,则密度为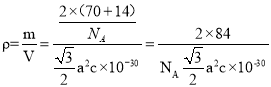 gcm-3。
gcm-3。

【题目】下图是物质间发生化学反应的颜色变化,下表选项物质对应正确的是
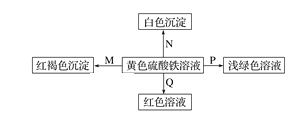
选项 | M | N | P | Q |
A | NH3·H2O | Ba(OH)2 | 铜 | KSCN |
B | Na | BaCl2 | FeO | KSCN |
C | NaOH | Ba(NO3)2 | 锌粉 | KSCN |
D | Na2O2 | MgCl2 | Fe | KSCN |
A.AB.BC.CD.D
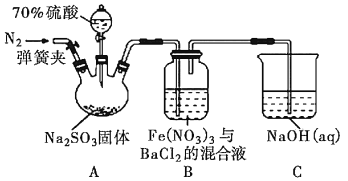
【题目】某化学兴趣小组用下面所示装置制取氯酸钾、次氯酸钠和氯水并进行探究实验。
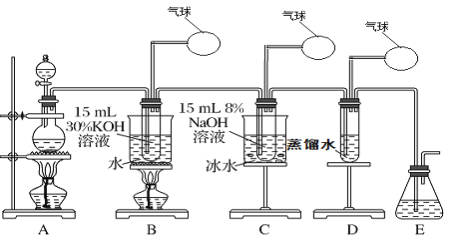
实验Ⅰ.制取氯酸钾(KClO3)、次氯酸钠、氯水
(1)写出装置A实验室制取Cl2的化学反应方程式_________________________
(2)制取实验结束后,取出装置B中的试管,冷却结晶、过滤、洗涤,该实验操作过程需要的玻璃仪器有胶头滴管、烧杯、________、________。
(3)写出B中制备氯酸钾(KClO3)的方程式____________________
(4)装置C中反应需要在冰水浴中进行,其原因是_____________________________
资料:SO2是一种酸性氧化物,与CO2相似,2NaOH(过量)+SO2=Na2SO3+H2O ,SO32-是还原性很强的离子,在溶液中与氧化性强的离子不能大量共存,易被氧化成SO42—。
实验Ⅱ.尾气处理
实验小组利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理。
(5)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和![]()
请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气中的CO2的影响)。
①提出合理假设:
假设1:只存在![]() ;
;
假设2:既不存在![]() 也不存在ClO-;
也不存在ClO-;
假设3:______________________________。
②设计实验方案,进行实验。请在表中写出实验步骤以及预期现象和结论。
限选实验试剂:3mol·L-1 H2SO4、1mol·L-1 NaOH溶液、0.01mol·L-1酸性KMnO4溶液、淀粉、KI溶液。
实验步骤 | 预期现象和结论 |
步骤1:取少量吸收液分置于A、B试管中 | |
步骤2:向A试管中滴加0.01 mol·L-1酸性KMnO4溶液 | (1)若溶液褪色,则假设1成立 (2)若溶液不褪色,则假设2或3成立 |
步骤3:____________________________________ | __________________________________ |
【题目】在3种不同条件下,分别向容积为1L的恒容密闭容器中充入4molA和2molB,发生反应:2A(g)+B(g)![]() 2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 3 | 3 | 2 |
化学平衡常数 | K1 | K2 | K3 |
A.实验Ⅲ达平衡后,恒温下再向容器中通入2 molA和2 molD,平衡正向移动
B.升高温度能加快反应速率的原理是降低了活化能,使活化分子百分数提高
C.实验Ⅰ达平衡后容器内的压强是实验Ⅲ的0.9倍
D.K3<K2 =K1