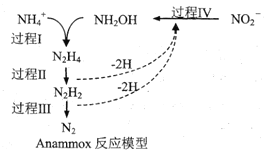
题目内容
【题目】用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
A.标准状况下,22.4LH2O含有的分子数为NA
B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C.1mol甲烷的质量与甲烷的摩尔质量相等
D.16g水中所含的电子数为10NA
【答案】B
【解析】
A.标况下水不是气体,不能根据气体摩尔体积来计算其物质的量,故A项错误;
B. Na2CO3的物质的量n=![]() =
=![]() =0.01mol,根据微粒数N=nNA得Na+的个数为:0.01mol×2NA mol-1=0.02NA,故B项正确;
=0.01mol,根据微粒数N=nNA得Na+的个数为:0.01mol×2NA mol-1=0.02NA,故B项正确;
C.1mol甲烷的质量为16g,甲烷的摩尔质量为16g/mol,二者的单位不同,故C错误;
D.1mol水中有10mol的电子,水的物质的量n=![]() =
=![]() =
=![]() mol,根据微粒数N=nNA得16g水中所含的电子数为N=
mol,根据微粒数N=nNA得16g水中所含的电子数为N=![]() mol×10NA mol-1=
mol×10NA mol-1=![]() NA,故D项错误;
NA,故D项错误;
答案为B。

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
【题目】在3种不同条件下,分别向容积为1L的恒容密闭容器中充入4molA和2molB,发生反应:2A(g)+B(g)![]() 2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
2D(g) △H=QkJ/mol,相关条件和数据见表。下列说法正确的是( )
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 3 | 3 | 2 |
化学平衡常数 | K1 | K2 | K3 |
A.实验Ⅲ达平衡后,恒温下再向容器中通入2 molA和2 molD,平衡正向移动
B.升高温度能加快反应速率的原理是降低了活化能,使活化分子百分数提高
C.实验Ⅰ达平衡后容器内的压强是实验Ⅲ的0.9倍
D.K3<K2 =K1