题目内容
20.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ.且1mol 氧气分子中的化学键完全断裂时吸收热量496kJ,水蒸气中1mol H-O键形成时放出热量463kJ,则氢气中1mol H-H键断裂时吸收热量为( )| A. | 920 kJ | B. | 557 kJ | C. | 436 kJ | D. | 188 kJ |
分析 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,1molH2O含有2molH-O键,1molH2中1mol H-H键,化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,依此结合反应方程式进行计算.
解答 解:氢气完全燃烧生成水蒸气是放热反应,所以化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设氢气中1molH-H键断裂时吸收热量为x,根据方程式:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,则:4×121kJ=463kJ×4-(2x+496kJ),解得x=436KJ,
故选C.
点评 本题考查学生化学反应中的能量变化知识,注意化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量是解题的关键,题目难度不大.

练习册系列答案
相关题目
9.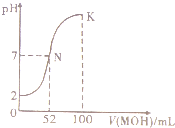 常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
 常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.02 mol.L-1 |
10.对乙烯基苯甲酸在医药中间体合成中有着广泛的用途,可用化合物M反应合成.下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )
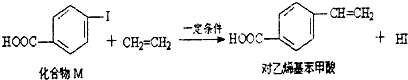

| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸即属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和聚合反应 |

 ,C
,C ,D
,D .
.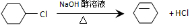 ;
; ;
; .
. C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).
C7H16的同分异构体中具有“手性碳原子”的有2种,写出其中一种的名称3-甲基己烷(或2,3-二甲基戊烷).

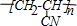 ,反应所属类型分别为加成反应、加聚反应.
,反应所属类型分别为加成反应、加聚反应. 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题: