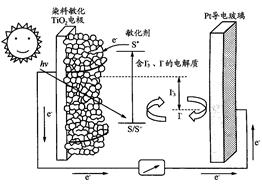
题目内容
(1)事实证明,原电池中发生的反应通常是放热反应。利用下列化学反应可以设计成原电池的是 。
A.C(s)+H2O(g) CO(g)+H2(g) ΔH>0
CO(g)+H2(g) ΔH>0
B.NaOH(aq)+HCl(aq) NaCl(aq)+H2O(l) ΔH<0
NaCl(aq)+H2O(l) ΔH<0
C.2H2(g) +O2(g) 2H2O(l) ΔH<0
2H2O(l) ΔH<0
D.CaCO3(s)+2HCl(aq) CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
E.CH4(g)+2O2(g) CO2(g)+2H2O(l) ΔH<0
CO2(g)+2H2O(l) ΔH<0
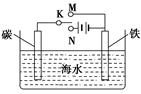
(2)有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断A、B、C、D的活动性由强到弱的顺序是 。
A.C(s)+H2O(g)
 CO(g)+H2(g) ΔH>0
CO(g)+H2(g) ΔH>0B.NaOH(aq)+HCl(aq)
 NaCl(aq)+H2O(l) ΔH<0
NaCl(aq)+H2O(l) ΔH<0C.2H2(g) +O2(g)
 2H2O(l) ΔH<0
2H2O(l) ΔH<0D.CaCO3(s)+2HCl(aq)
 CaCl2(aq)+H2O(l)+CO2(g) ΔH<0
CaCl2(aq)+H2O(l)+CO2(g) ΔH<0E.CH4(g)+2O2(g)
 CO2(g)+2H2O(l) ΔH<0
CO2(g)+2H2O(l) ΔH<0(2)有A、B、C、D四种金属,将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀。将A、D分别投入等物质的量浓度的盐酸中,D比A反应剧烈。将铜浸入B的盐溶液里,无明显变化,如果把铜浸入C的盐溶液里,有金属C析出。据此判断A、B、C、D的活动性由强到弱的顺序是 。
(1)CE (2)D>A>B>C
(1)原电池是自发进行的氧化还原反应,由条件知反应通常是放热反应,A为吸热反应,B、D不是氧化还原反应,选C、E。(2)本题考查原电池原理的应用。根据原电池原理:活动性不同的金属组成原电池时,活泼金属作负极,失电子,发生氧化反应,较不活泼的金属作正极,据此可以判断金属活动性的强弱。活泼金属作负极,被腐蚀,所以活动性A>B;A、D与等浓度盐酸反应时D比A反应剧烈,说明活动性D>A;铜与B的盐溶液不反应,但铜可置换出C,说明活动性B>C。即活动性由强到弱的顺序为D>A>B>C。

练习册系列答案
相关题目
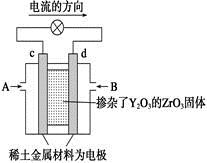
 Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )
Al2O3 + 3H2↑,电解过程中,以下判断正确的是( )

 C+6H2O
C+6H2O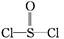 )中而形成的,电池总反应方程式为:8Li+3SOCl2
)中而形成的,电池总反应方程式为:8Li+3SOCl2 6LiCl+Li2SO3+2S,下列叙述中正确的是( )
6LiCl+Li2SO3+2S,下列叙述中正确的是( )

 TiO2/S*(激发态)
TiO2/S*(激发态)