题目内容
某兴趣小组利用如图所示装置进行实验。
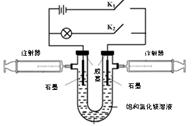
(1)断开K2、闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;阳极电极反应式为 。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体 mL(折算为标准状况)。
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,断开K1、闭合K2,此时装置内化学能转化为电能。实现能量转化的化学方程式为 ;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上 (填“能”或“不能”)恢复原样。

(1)断开K2、闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;阳极电极反应式为 。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体 mL(折算为标准状况)。
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,断开K1、闭合K2,此时装置内化学能转化为电能。实现能量转化的化学方程式为 ;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上 (填“能”或“不能”)恢复原样。
(1)有白色沉淀生成 2Cl- - 2e-=Cl2↑ 11.2 (2)H2+Cl2=2HCl (3)能
试题分析:(1)若断开K2、闭合K1,该装置为电解池。左边的石墨电极为阳极,右边的石墨电极为阴极。在阳极由于放电能力Cl->OH-,所以发生反应:2Cl—2e-=Cl2↑。在阴极由于放电能力H+>Mg2+,因此在阴极发生反应:2H++2e-=H2↑。H+不断放电,破坏了附近的水的电离平衡,水继续电离。最终使附近的水溶液显碱性。这时会发生反应:Mg2+ +2OH-=Mg(OH)2↓.因此在U形管内除电极上有气泡外,还可观察到有白色沉淀生成。当电路中转移0.001mol电子时,根据电子守恒可知右侧注射器收集的H2的物质的量为0.0005mol.其在标准状况下的体积为0.0005mo×22.4L/mol=0.0112L=11.2ml.(2)若断开K2、闭合K1,发生的的电解池反应,左边收集的是Cl2,右边收集的是H2。此时断开K1、闭合K2,装置内就实现化学能转化为电能。即发生了原电池反应。实现能量转化的化学方程式为H2+Cl2=2HCl。(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,根据能量守恒定律,U形管内的溶液理论上能恢复原样。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
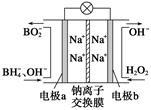
 CO(g)+H2(g) ΔH>0
CO(g)+H2(g) ΔH>0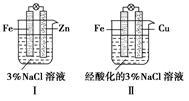
 Zn电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充Ag2O和少量石墨组成的正极活性材料,负极盖一端填充Zn
Zn电池,它用不锈钢制成一个由正极壳和负极盖组成的小圆盒,盒内靠正极壳一端填充Ag2O和少量石墨组成的正极活性材料,负极盖一端填充Zn B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为C2++2e-=C,B-2e-=B2+,则A、B、C、D金属性由强到弱的顺序为( )。
B;当A、D组成原电池时,A为正极;B与C构成原电池时,电极反应式为C2++2e-=C,B-2e-=B2+,则A、B、C、D金属性由强到弱的顺序为( )。 AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作: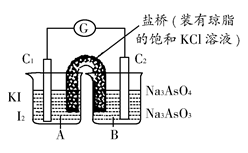
 2PbSO4+2H2O
2PbSO4+2H2O