题目内容
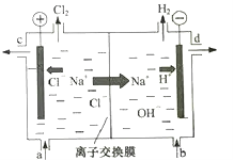
【题目】如图是一个电化学原理的示意图。已知甲池的总反应式为:2CH3OH+3O2+4KOH=2K2CO3+6H2O。填写下列空白:
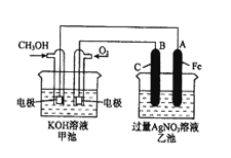
(1)请写出甲、乙两池的名称。甲电池是______,乙池是______。
(2)甲池中通入CH3OH的电极名称是___,电极反应方程式为:______;乙池中B(石墨)电极的名称是_______。
(3)电解过程中,乙池溶液pH的变化为_______(“升高”、“降低”或“不变”)。
(4)当乙池中A(Fe)极的质量增加5.40 g时,甲池中理论上消耗O2_____mL(标准状况下)。
(5)若乙池中的AgNO3换成一定量CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1 molCu(OH)2后恰好恢复到电解前的浓度和pH,则电解过程中转移的电子数为___mol。(忽略溶液体积的变化)
【答案】原电池 电解池 负极 CH3OH-6e-+8OH-=CO32-+6H2O 阳极 降低 280 0.4
【解析】
(1)甲池为燃料电池,属于原电池,乙池为电解池;
(2)在燃料电池中通入燃料的电极为负极,通入O2的电极为正极,结合电解质溶液书写电极反应式;
(3)根据电解池电极反应式,可得总反应方程式,根据其中的物质变化确定溶液的pH;
(4)先计算Ag的物质的量,利用同一闭合回路中电子转移数目相同,计算O2的物质的量和体积;
(5)乙池中加入0.1 mol Cu(OH)2溶液恢复电解前的溶液的浓度和pH,相当于反应消耗了0.1 mol CuO、0.1 mol H2O,根据电解方程式,结合同一闭合回路中电子转移数目相等计算反应过程中电子转移的物质的量。
(1)根据装置图可知甲池是燃料电池,属于原电池;乙池与原电池连接,属于电解池;
(2)甲池中通入CH3OH的电极名称是负极,由于电解质溶液为碱性,所以CH3OH失去电子变为CO32-,电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O;乙池中B(石墨)电极与原电池的正极连接,作电解池的阳极;
(3)电解过程中,在乙池中,阳极B(石墨)电极发生氧化反应,电解质溶液为AgNO3溶液,由于阴离子放电能力:OH->NO3-,所以阳极发生反应:4OH--4e-=2H2O+O2↑,阴极上发生电极反应式:4Ag++4e-=4Ag,总反应方程式为4AgNO3+2H2O![]() 4Ag+4HNO3+O2↑,可见电解后溶液的酸性增强,溶液pH降低;
4Ag+4HNO3+O2↑,可见电解后溶液的酸性增强,溶液pH降低;
(4)在同一闭合回路中电子转移数目相等,当乙池中A(Fe)极的质量增加5.40 g时,反应产生的Ag的物质的量为n(Ag)=![]() =0.05 mol,Ag是+1价的金属,则反应过程中电子转移的物质的量n(e-)= n(Ag)=0.05 mol,则甲池中理论上消耗O2的物质的量n(O2)=
=0.05 mol,Ag是+1价的金属,则反应过程中电子转移的物质的量n(e-)= n(Ag)=0.05 mol,则甲池中理论上消耗O2的物质的量n(O2)= ![]() n(e-)=
n(e-)=![]() ×0.05 mol=0.0125 mol,所以反应放出O2的体积V(O2)= 0.0125 mol×22.4 L/mol=0.28 L=280 mL。
×0.05 mol=0.0125 mol,所以反应放出O2的体积V(O2)= 0.0125 mol×22.4 L/mol=0.28 L=280 mL。
(5)乙池加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,发生如下电解:2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4、2H2O
2Cu+O2↑+2H2SO4、2H2O![]() 2H2↑+O2↑,Cu(OH)2从组成上可看成CuO、H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,CuO、H2O的物质的量都是0.1 mol,则阴极上析出氢气和铜,生成0.1 mol铜转移电子n(e-)=0.1 mol×2=0.2 mol;根据原子守恒知,生成0.1mol水需要0.1 mol氢气,生成0.1 mol氢气转移电子n(e-)=0.1 mol×2=0.2 mol,所以电解过程中电子转移总物质的量n(e-)总=0.2 mol +0.2 mol =0.4 mol。
2H2↑+O2↑,Cu(OH)2从组成上可看成CuO、H2O,根据“析出什么加入什么”的原则知,析出的物质是氧化铜和水,CuO、H2O的物质的量都是0.1 mol,则阴极上析出氢气和铜,生成0.1 mol铜转移电子n(e-)=0.1 mol×2=0.2 mol;根据原子守恒知,生成0.1mol水需要0.1 mol氢气,生成0.1 mol氢气转移电子n(e-)=0.1 mol×2=0.2 mol,所以电解过程中电子转移总物质的量n(e-)总=0.2 mol +0.2 mol =0.4 mol。

 名校课堂系列答案
名校课堂系列答案