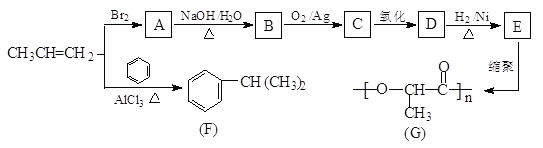
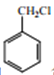
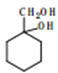
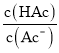题目内容
【题目】以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如图所示,其中P端通入CO2,通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是( )
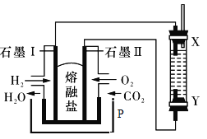
A.X、Y两端都必须用铁作电极
B.不可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H++2e-=H2↑
D.白色沉淀只能在阳极上产生
【答案】C
【解析】
左边装置是原电池,为氢氧燃料电池,通入氢气的电极I为负极、通入氧气的电极II为正极,负极反应式为H2-2e-+CO32-═CO2+H2O,正极反应式为O2+4e-+2CO2=2CO32-,右边装置是电解池,X是阴极、Y是阳极,阴极反应式为2H2O+2e-=H2↑+2OH-、阳极反应式为Fe-2e-+2OH-= Fe(OH)2↓,则Y电极材料应该为Fe,据此分析解答。
根据上述分析可知石墨电极I为负极,石墨电极II为正极,X为阴极,Y为阳极Fe。
A.通过以上分析知,Y电极为阳极,必须是Fe电极,但X电极不一定是Fe,A错误;
B.电解过程是阴极上H+放电生成H2,同时生成OH-,OH-和阳极反应产生的Fe2+结合生成Fe(OH)2,溶液呈碱性,所以可以用NaOH溶液作为电解液,B错误;
C.阴极上H+放电生成氢气,阴极反应式为2H++2e-=H2↑,C正确;
D.电解时电解质溶液中阳离子向阴极移动,所以白色沉淀可以在阴极产生,D错误;
故合理选项是C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目