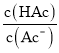题目内容
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
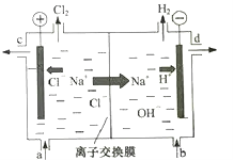
完成下列填空:
(1)写出电解饱和食盐水的离子方程式___。
(2)精制饱和食盐水从图中___位置补充,氢氧化钠溶液从图中___位置流出(选填“a”、“b”、“c”或“d”)。
(3)KClO3可以和草酸(H2C2O4)、硫酸反应生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。
写出该反应的化学方程式___。
(4)室温下,0.1mol/LNaClO溶液的pH___0.1mol/LNa2SO3溶液的pH(选填“大于”、“小于”或“等于”)。
(5)浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为___。
已知:H2SO3:Ki1=1.54×102,Ki2=1.02×107,HClO:Ki1=2.95×108,H2CO3:Ki1=4.3×107,Ki2=5.6×1011。
【答案】2Cl-+2H2O![]() Cl2↑+H2↑+2OH- a d 2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O 大于 c(SO32–)>c(CO32–)>c(HCO3–)>c(HSO3–)
Cl2↑+H2↑+2OH- a d 2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O 大于 c(SO32–)>c(CO32–)>c(HCO3–)>c(HSO3–)
【解析】
电解食盐水时,阳极氯离子失电子生成氯气,阴极氢离子得电子生成氢气。图中的离子交换膜只允许阳离子通过,即只允许钠离子、氢离子通过向阴极移动。
(1)电解饱和食盐水时,溶液中的阳离子H+在阴极得到电子变为H2逸出,使附近的水溶液显碱性,溶液中的阴离子Cl-在阳极失去电子,发生氧化反应,产生Cl2。反应的离子方程式是2Cl-+2H2O![]() Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(2)随着电解的进行,溶质NaCl不断消耗,所以应该及时补充。阳极氯离子不断消耗,钠离子向阴极移动,导致阳极区钠离子、氯离子减少,故精制饱和食盐水从与阳极连接的图中a位置补充。由于阴极H+不断放电,附近的溶液显碱性,氢氧化钠溶液从图中d位置流出。
(3)KClO3有氧化性,H2C2O4有还原性,在酸性条件下KClO3可以和草酸(H2C2O4)生成高效的消毒杀菌剂ClO2,还生成CO2和KHSO4等物质。则根据电子守恒及原子守恒,可得该反应的化学方程式是:2KClO3+ H2C2O4+ 2H2SO4= 2ClO2+2CO2+2KHSO4+2H2O。
(4)NaClO、Na2SO3都是强碱弱酸盐,形成盐的酸越弱,盐水解程度就越大。消耗的离子浓度越大,当溶液达到平衡时,剩余的离子浓度就越小。由于H2SO3的Ki2=1.02×10-7;HClO的Ki1=2.95×10-8,所以酸性:HSO3->HClO,因此溶液的pH: NaClO> Na2SO3。
(5)由于电离程度:H2SO3> H2CO3>HSO3->HCO3-,浓度均为0.1 mol/L 的Na2SO3和Na2CO3的混合溶液中,水解程度:CO32–>SO32–,所以离子浓度:SO32–>CO32–;水解产生的离子浓度:HCO3-> HSO3-。但是盐水解程度总的来说很小,主要以盐电离产生的离子存在。所以在该溶液中SO32–、CO32–、HSO3–、HCO3–浓度从大到小的顺序为c(SO32–)>c(CO32–)>c(HCO3–)
>c(HSO3–)。

 走进文言文系列答案
走进文言文系列答案