题目内容
【题目】苯胺(![]() )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和 NH3 相似,与盐酸反应生成易溶于水的盐
和 NH3 相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理:2![]() +3Sn+12HCl→2
+3Sn+12HCl→2![]() +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/gcm-3 |
苯胺 | -6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
硝基苯 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
乙醚 | -116.2 | 34.6 | 微溶于水 | 0.7134 |
Ⅰ.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为__________;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是______。
Ⅱ.制备苯胺。往图所示装置(夹持装置略,下同)的冷凝管口分批加入 20mL 浓盐酸(过量),置于热水浴中回流 20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量 50% NaOH 溶液,至溶液呈碱性。
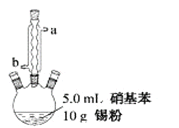
(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加 NaOH 溶液的主要目的是析出苯胺,反应的离子方程式为______________。
Ⅲ.提取苯胺。
i.取出上图所示装置中的三颈烧瓶,改装为如图所示装置:
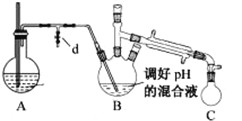
ii.加热装置 A 产生水蒸气,烧瓶 C 中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
ii.往所得水溶液加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用 NaOH 固体干燥,蒸馏后得到苯胺 2.79g。
(4)装置B无需用到温度计,理由是______。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是__________。
(6)该实验中苯胺的产率为 _____________。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案: _________________。
【答案】NH3+HCl=NH4Cl 苯胺沸点较高,不易挥发 b C6H5NH3++OH-→ C6H5NH2+H2O 蒸出物为混合物,无需控制温度 防止 B 中液体倒吸 60.0% 加入稀盐酸,分液除去硝基苯,再加入氢氧化钠溶液,分液去水层后,加入 NaOH固体干燥、过滤
【解析】
(1)根据浓氨水和浓盐酸都具有挥发性结合题中信息苯胺沸点184℃分析;
(2)为了获得较好的冷凝效果,采用逆流原理;
(3)根据题中信息,联系铵盐与碱反应的性质,通过类比迁移,不难写出离子方程式;
(4)根据蒸馏产物分析;
(5)根据装置内压强突然减小会引起倒吸分析;
(6)根据关系式即可计算苯胺的产率;
(7)根据物质的性质分析作答。
(1)蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,是浓氨水挥发出来的NH3和浓盐酸挥发出来的HCl反应生成NH4Cl固体小颗粒,化学方程式为:NH3+HCl=NH4Cl;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是苯胺沸点184℃,比较高,不易挥发;
(2)图1装置包含了产品的分馏,是根据各组分的沸点的不同、用加热的方法来实现各组分的分离的操作,冷凝管是下口进水,上口出水,保证冷凝效果,故答案为:b;
(3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为C6H5NH3++OH-→C6H5NH2+H2O;
(4)因为蒸馏出来的是水和苯胺的混合物,故无需温度计;
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是防止装置B内压强突然减小引起倒吸;
(6)设理论上得到苯胺m,根据原子守恒可知C6H5NO2~C6H5NH2,则m=![]() =4.65g,所以该实验中苯胺的产率=
=4.65g,所以该实验中苯胺的产率=![]() ×100%=60%;
×100%=60%;
(7)在混合物中先加入足量盐酸,经分液除去硝基苯,再往水溶液中加NaOH溶液析出苯胺,分液后用NaOH固体干燥苯胺中还含有的少量水分,滤去NaOH固体,即可得较纯净的苯胺,即实验方案是:加入稀盐酸,分液除去硝基苯,再加入氢氧化钠溶液,分液去水层后,加入 NaOH固体干燥、过滤。