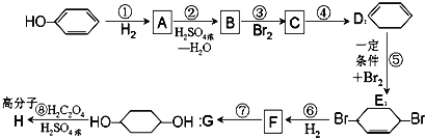
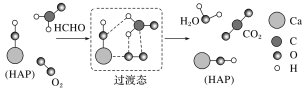
题目内容
【题目】铜单质及其化合物在很多领域有重要的用途.
(一)如金属铜用来制造电线电缆,超细铜粉可应用于导电材料、催化剂等领域中;CuCl和![]() 都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等.
(1)超细铜粉的某制备方法如下:
![]()
![]() 中的配体是_______________________ 。
中的配体是_______________________ 。
(2)氯化亚铜![]() 的制备过程是:向
的制备过程是:向![]() 溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀,反应的离子方程式为_______________________________________________________ 。
溶液中通入一定量SO2,微热,反应一段时间后即生成CuCl白色沉淀,反应的离子方程式为_______________________________________________________ 。
(二)波尔多液是一种保护性杀菌剂,广泛应用于树木、果树和花卉上,鲜蓝色的胆矾晶体是配制波尔多液的主要原料.
(1)与铜同周期的所有元素的基态原子中最外层电子数与铜原子相同的元素有 _______________________ ![]() 填元素符号
填元素符号![]() 。
。
(2)往浓![]() 溶液中加入过量较浓的
溶液中加入过量较浓的![]() 直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的
直到原先生成的沉淀恰好溶解为止,得到深蓝色溶液.小心加入约和溶液等体积的![]() 并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色晶体是____________________(写化学式),实验中所加
并使之分成两层,静置.经过一段时间后可观察到在两层“交界处”下部析出深蓝色晶体是____________________(写化学式),实验中所加![]() 的作用是________________________。
的作用是________________________。
(3)![]() 晶体中呈正四面体的原子团是______ ,杂化轨道类型是
晶体中呈正四面体的原子团是______ ,杂化轨道类型是![]() 杂化的原子是____________。
杂化的原子是____________。
【答案】NH3 ![]() K、Cr
K、Cr ![]() 加
加![]() ,减小“溶剂”
,减小“溶剂”![]() 和
和![]() 的极性,降低溶解度
的极性,降低溶解度 ![]() N、S、O
N、S、O
【解析】
(一) (1) 根据配合物的组成判断;
(2)CuCl2与SO2反应生成CuCl沉淀和硫酸;
(二) (1)根据铜的电子排布式分析;
(2)![]() 在酒精中的溶解度小于在水溶液中的溶解度;
在酒精中的溶解度小于在水溶液中的溶解度;
(3)![]() 晶体中呈正四面体的原子团是
晶体中呈正四面体的原子团是![]() ,杂化轨道类型是
,杂化轨道类型是![]() ,其价层电子对个数是4。
,其价层电子对个数是4。
(一) (1)根据配合物的组成可以判断![]() 中的配体是NH3;
中的配体是NH3;
(2)CuCl2与SO2反应生成CuCl沉淀和硫酸,其反应的离子方程式为:![]() ;
;
(二) (1)Cu元素为29号元素,原子核外有29个电子,所以核外电子排布式为:1s22s22p63s23p63d104s1,所以Cu原子中有1个未成对电子,第四周期中最外层电子数为1的元素还有:钾其外围电子排布式为4s1,铬其外围电子排布式为3d5 4s1,答案为K、Cr;
(2)在两层“交界处”下部析出深蓝色晶体是![]() ;
;
实验中加![]() ,减小“溶剂”
,减小“溶剂”![]() 和
和![]() 的极性,降低溶解度;
的极性,降低溶解度;
(3)![]() 晶体中呈正四面体的原子团是
晶体中呈正四面体的原子团是![]() ,杂化轨道类型是
,杂化轨道类型是![]() ,其价层电子对个数是4,有N原子、S原子和O原子。
,其价层电子对个数是4,有N原子、S原子和O原子。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】苯胺(![]() )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和 NH3 相似,与盐酸反应生成易溶于水的盐
和 NH3 相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理:2![]() +3Sn+12HCl→2
+3Sn+12HCl→2![]() +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/gcm-3 |
苯胺 | -6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
硝基苯 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
乙醚 | -116.2 | 34.6 | 微溶于水 | 0.7134 |
Ⅰ.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为__________;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是______。
Ⅱ.制备苯胺。往图所示装置(夹持装置略,下同)的冷凝管口分批加入 20mL 浓盐酸(过量),置于热水浴中回流 20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量 50% NaOH 溶液,至溶液呈碱性。
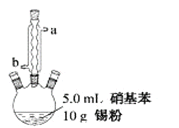
(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加 NaOH 溶液的主要目的是析出苯胺,反应的离子方程式为______________。
Ⅲ.提取苯胺。
i.取出上图所示装置中的三颈烧瓶,改装为如图所示装置:
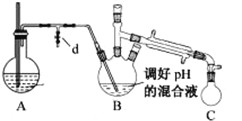
ii.加热装置 A 产生水蒸气,烧瓶 C 中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
ii.往所得水溶液加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用 NaOH 固体干燥,蒸馏后得到苯胺 2.79g。
(4)装置B无需用到温度计,理由是______。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是__________。
(6)该实验中苯胺的产率为 _____________。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案: _________________。