题目内容
【题目】科研工作者结合实验与计算机模拟来研究钌催化剂表面不同位点上合成氨反应历程,如图所示,其中实线表示位点A上合成氨的反应历程,虚线表示位点B上合成氨的反应历程,吸附在催化剂表面的物种用*标注。下列说法错误的是

A.由图可以判断合成氨反应属于放热反应
B.氮气在位点A上转变成2N*速率比在位点B上的快
C.整个反应历程中活化能最大的步骤是2N*+3H2→2N*+6H*
D.从图中知选择合适的催化剂位点可加快合成氨的速率
【答案】C
【解析】
A.据图可知,始态*N2+3H2的相对能量为0eV,生成物*+2NH3的相对能量约为-1.8eV,反应物的能量高于生成物,所以为放热反应,故A正确;
B.图中实线标示出的位点A最大能垒(活化能)低于图中虚线标示出的位点B最大能垒(活化能),活化能越低,有效碰撞几率越大,化学反应速率越大,故B正确;
C.由图像可知,整个反应历程中2N*+3H2→2N*+6H*活化能几乎为零,为最小,故C错误;
D.由图像可知氮气活化在位点A上活化能较低,速率较快,故D正确;
故答案为C。

【题目】甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。
(1)已知 ①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH= + 93.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③甲醇的燃烧热为726.51kJ·mol-1。
要写出表示甲醇燃烧热的热化学方程式,还缺少的热化学方程式为________________。
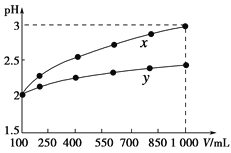
(2)甲醇可采用煤的气化、液化制取(CO+2H2CH3OH ΔH<0)。在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,反应达到平衡时CH3OH的体积分数(V%)与![]() 的关系如图所示。
的关系如图所示。
①当起始![]() =2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
=2,经过5min达到平衡,0~5min内平均反应速率v(H2)=0.1molL-1min-1,则该条件CO的平衡转化率为_____;若其它条件不变,在T2℃(T2>T1)下达到平衡时CO的体积分数可能是____(填标号)
A.<![]() B.=
B.=![]() C.
C.![]() ~
~ ![]() D.=
D.=![]() E.>
E.> ![]()
②当![]() =3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的____点选填“D”、“E”或“F”)。
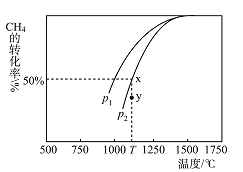
(3)制甲醇的CO和H2可用天然气来制取:CO2(g)+CH4(g)2CO(g)+2H2(g)。在某一密闭容器中有浓度均为0.1mol·L1的CH4和CO2,在一定条件下反应,测得CH4的平衡转化率与温度及压强的关系如图所示,则该反应的ΔH______(选填“大于”“小于”或“等于”)0。压强p1_______(选填“大于”或“小于”)p2。当压强为p2时,在y点:v(正)__________(选填“大于”“小于”或“等于”)v(逆)。若p2=6Mpa,则T℃时该反应的平衡常数Kp=_____MPa2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)研究表明:CO2和H2在一定条件下也可以合成甲醇,反应方程式为CO2(g)+3H2(g)CH3OH(g)+H2O(g) [反应Ⅰ]。
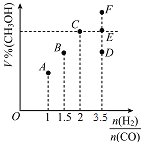
①一定条件下,往2L恒容密闭容器中充入2.0mol CO2和4.0mol H2,在不同催化剂作用下合成甲醇,相同时间内CO2的转化率随温度变化如下图所示,其中活化能最高的反应所用的催化剂是____(填“A”、“B”或“C”)。

②在某催化剂作用下,CO2和H2除发生反应①外,还发生如下反应CO2(g)+H2(g)CO(g)+H2O(g)[反应Ⅱ]。维持压强不变,按固定初始投料比将CO2和H2按一定流速通过该催化剂,经过相同时间测得实验数据:
T(K) | CO2实际转化率(%) | 甲醇选择性(%) |
543 | 12.3 | 42.3 |
553 | 15.3 | 39.1 |
注:甲醇的选择性是指发生反应的CO2中转化为甲醇的百分比。
表中数据说明,升高温度,CO2的实际转化率提高而甲醇的选择性降低,其原因是_________。
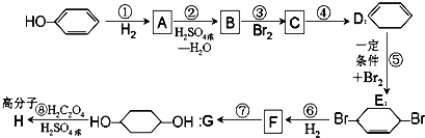
【题目】三苯甲醇(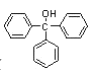 )是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:
)是重要的有机合成中间体。实验室中合成三苯甲醇时采用如图所示的装置,其合成流程如图:
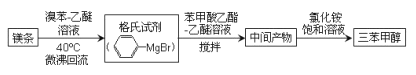
已知:①格氏试剂易潮解,生成可溶于水的 Mg(OH)Br。
②三苯甲醇可通过格氏试剂与苯甲酸乙酯按物质的量比2:1反应合成
③相关物质的物理性质如下:
物质 | 相对分子量 | 沸点 | 熔点 | 溶解性 |
三苯甲醇 | 260 | 380℃ | 164.2℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
乙醚 | - | 34.6℃ | -116.3℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
溴苯 | - | 156.2℃ | -30.7℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
苯甲酸乙酯 | 150 | 212.6℃ | -34.6℃ | 不溶于水 |
请回答下列问题:
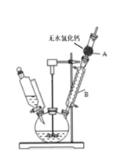
(1)合成格氏试剂:实验装置如图所示,仪器A的名称是____,已知制备格氏试剂的反应剧烈放热,但实验开始时常加入一小粒碘引发反应,推测I2的作用是____。使用无水氯化钙主要是为避免发生____(用化学方程式表示)。
(2)制备三苯甲醇:通过恒压滴液漏斗往过量的格氏试剂中加入13mL苯甲酸乙酯(0.09mol)和15mL无水乙醚的混合液,反应剧烈,要控制反应速率除使用冷水浴外,还可以 ___(答一点)。回流0.5h后,加入饱和氯化铵溶液,有晶体析出。
(3)提纯:冷却后析出晶体的混合液含有乙醚、溴苯、苯甲酸乙酯和碱式溴化镁等杂质,可先通过 ___(填操作方法,下同)除去有机杂质,得到固体17.2g。再通过 ___纯化,得白色颗粒状晶体16.0g,测得熔点为164℃。
(4)本实验的产率是____(结果保留两位有效数字)。本实验需要在通风橱中进行,且不能有明火,原因是____。
【题目】苯胺(![]() )是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
)是重要的化工原料。某兴趣小组在实验室里进行苯胺的相关实验。
已知:①![]() 和 NH3 相似,与盐酸反应生成易溶于水的盐
和 NH3 相似,与盐酸反应生成易溶于水的盐![]()
②用硝基苯制取苯胺的反应原理:2![]() +3Sn+12HCl→2
+3Sn+12HCl→2![]() +3SnCl4+4H2O
+3SnCl4+4H2O
③有关物质的部分物理性质见表:
物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度/gcm-3 |
苯胺 | -6.3 | 184 | 微溶于水,易溶于乙醚 | 1.02 |
硝基苯 | 5.7 | 210.9 | 难溶于水,易溶于乙醚 | 1.23 |
乙醚 | -116.2 | 34.6 | 微溶于水 | 0.7134 |
Ⅰ.比较苯胺与氨气的性质
(1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为__________;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是______。
Ⅱ.制备苯胺。往图所示装置(夹持装置略,下同)的冷凝管口分批加入 20mL 浓盐酸(过量),置于热水浴中回流 20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量 50% NaOH 溶液,至溶液呈碱性。

(2)冷凝管的进水口是____(填“a”或“b”);
(3)滴加 NaOH 溶液的主要目的是析出苯胺,反应的离子方程式为______________。
Ⅲ.提取苯胺。
i.取出上图所示装置中的三颈烧瓶,改装为如图所示装置:
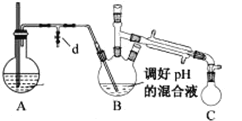
ii.加热装置 A 产生水蒸气,烧瓶 C 中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。
ii.往所得水溶液加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。
iii.合并粗苯胺和乙醚萃取液,用 NaOH 固体干燥,蒸馏后得到苯胺 2.79g。
(4)装置B无需用到温度计,理由是______。
(5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是__________。
(6)该实验中苯胺的产率为 _____________。
(7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案: _________________。