题目内容
【题目】锰的化合物是优良的催化剂,可用于干电池原料生产等.
(1)锌锰干电池的反应为2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2 , MnO(OH)中锰元素的化合价为 .
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为(填化学式).[已知Ksp(MnS)=1.4×10﹣15 , Ksp(ZnS)=2.9×10﹣25 , Ksp(FeS)=6.0×10﹣18]
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g)△H1 , 其反应机理如图:
①已知反应Ⅱ为MnO2(s)+H2O2(1)+2H+ ( aq)=Mn2+ (aq)+O2(g)+2H2O(1)△H2 . 写出反应 I的热化学方程式(焓变用△H1和△H2表示): .
②某温度时,向10mL0.4mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2=2H2O+O2 , 测得不同时刻生成O2的体积(已折算为标准状况下的体积)如表:
t/min | 0 | 2 | 4 | 6 |
V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
0~2min时反应速率比2~4min时的快,其原因是 , 0~6min的平均反应速率v(H2O2)=(忽略溶液体积的变化).
(4)锰基催化剂是合成甲醇、二甲醚的催化剂.已知:
反应 | 平衡常数KP | |
773K | 873K | |
Ⅰ.CO2(g)+4H2(g)CH4(g)+2H2(g) | 19.4 | 0.803 |
Ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
①反应I的正反应是(填“放热”或“吸热”)反应.
②反应Ⅱ的平衡常数表达式为 . 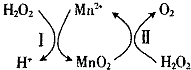
【答案】
(1)+3
(2)ZnS
(3)H2O2(1)+Mn2+(aq)=2H+(aq)+MnO2(s)△H=△H1﹣△H2;随着反应的进行,H2O2浓度不断减小,反应速率不断减慢;3.3×10﹣2mol/(L?min)
(4)放热;K= ![]()
【解析】解:(1)MnO(OH)中O元素的化合价为﹣2价,H元素的化合价为+1价,根据正负化合价的代数和为0,锰元素的化合价为+3价,所以答案是:+3;(2)因为Ksp(MnS)=1.4×10﹣15>Ksp(FeS)=6.0×10﹣18>Ksp(ZnS)=2.9×10﹣25 , 向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成溶解度最小的物质,最先生成的沉淀为ZnS,所以答案是:ZnS;(3)①转化关系可知,过氧化氢和锰离子反应得到二氧化锰和氢离子,2H2O2(l)═2H2O(l)+O2(g)△H1①,MnO2(s)+H2O2(l)+2H+═Mn2+(aq)+O2(g)+2H2O(l)△H2 , ②依据盖斯定律①﹣②得到H2O2(l)+Mn2+(aq)═MnO2(s)+2H+(aq)△H=△H1﹣△H2所以答案是:H2O2(l)+Mn2+(aq)═MnO2(s)+2H+(aq)△H=△H1﹣△H2②0~2min产生的氧气的物质的量n(O2)= ![]() =0.00044mol,n(H202)=2n(O2)=0.00088mol,v(H2O2)=
=0.00044mol,n(H202)=2n(O2)=0.00088mol,v(H2O2)= ![]() ≈4.4×10﹣2mol/(Lmin),4~6min产生的氧气的物质的量n(O2)=
≈4.4×10﹣2mol/(Lmin),4~6min产生的氧气的物质的量n(O2)= ![]() =2.3×10﹣4mol,n(H202)=2n(O2)=4.6×10﹣4mol,v(H202)=
=2.3×10﹣4mol,n(H202)=2n(O2)=4.6×10﹣4mol,v(H202)= ![]() =2.3×10﹣2mol/Lmin,0~2min H2O2平均反应速率比4~6min快,原因为随着反应的进行,H2O2浓度不断减小,反应速率不断减慢;0~6min产生的氧气的物质的量n(O2)=
=2.3×10﹣2mol/Lmin,0~2min H2O2平均反应速率比4~6min快,原因为随着反应的进行,H2O2浓度不断减小,反应速率不断减慢;0~6min产生的氧气的物质的量n(O2)= ![]() =0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)=
=0.001mol,n(H202)=2n(O2)=0.002mol,v(H202)= ![]() ≈3.3×10﹣2mol/(Lmin),所以答案是:②随着反应的进行,H2O2浓度不断减小,反应速率不断减慢;3.3×10﹣2mol/(Lmin);(4)①温度有773K升高到873K,平衡常数减小,表明升高温度,平衡向逆反应方向移动,说明正反应是放热反应,所以答案是:放热;②反应Ⅱ为CO2(g)+3H2(g)CH3OH(g)+H2O(g),其平衡常数表达式为K=
≈3.3×10﹣2mol/(Lmin),所以答案是:②随着反应的进行,H2O2浓度不断减小,反应速率不断减慢;3.3×10﹣2mol/(Lmin);(4)①温度有773K升高到873K,平衡常数减小,表明升高温度,平衡向逆反应方向移动,说明正反应是放热反应,所以答案是:放热;②反应Ⅱ为CO2(g)+3H2(g)CH3OH(g)+H2O(g),其平衡常数表达式为K= ![]() ,所以答案是:K=
,所以答案是:K= ![]() .
.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.