题目内容
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A. 含有NA个氦原子的氦气在标准状况下的体积约为11.2L
B. 在常温常压下,11.2L Cl2含有的分子数为0.5NA
C. 25℃,101KPa,64gSO2中含有的原子数为3NA
D. 标准状况下,11.2LH2O含有的分子数为0.5NA
【答案】C
【解析】A、含有NA个氦原子的氦气在标准状况下的体积约为22.4L,故A错误;B、在标准状况下,11.2L Cl2含有的分子数为0.5NA,故B错误;C、 25℃,101KPa,64gSO2中含有的原子数为3NA,故C正确;D、标准状况下,H2O是液体,故D错误;故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】锰的化合物是优良的催化剂,可用于干电池原料生产等.
(1)锌锰干电池的反应为2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2 , MnO(OH)中锰元素的化合价为 .
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为(填化学式).[已知Ksp(MnS)=1.4×10﹣15 , Ksp(ZnS)=2.9×10﹣25 , Ksp(FeS)=6.0×10﹣18]
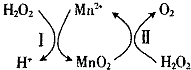
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g)△H1 , 其反应机理如图:
①已知反应Ⅱ为MnO2(s)+H2O2(1)+2H+ ( aq)=Mn2+ (aq)+O2(g)+2H2O(1)△H2 . 写出反应 I的热化学方程式(焓变用△H1和△H2表示): .
②某温度时,向10mL0.4mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2=2H2O+O2 , 测得不同时刻生成O2的体积(已折算为标准状况下的体积)如表:
t/min | 0 | 2 | 4 | 6 |
V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
0~2min时反应速率比2~4min时的快,其原因是 , 0~6min的平均反应速率v(H2O2)=(忽略溶液体积的变化).
(4)锰基催化剂是合成甲醇、二甲醚的催化剂.已知:
反应 | 平衡常数KP | |
773K | 873K | |
Ⅰ.CO2(g)+4H2(g)CH4(g)+2H2(g) | 19.4 | 0.803 |
Ⅱ.CO2(g)+3H2(g)CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
①反应I的正反应是(填“放热”或“吸热”)反应.
②反应Ⅱ的平衡常数表达式为 .