题目内容
20.某元素二价阴离子核外有18个电子,质量数为32,该元素氢化物1mol含中子数( )| A. | 12 mol | B. | 14 mol | C. | 16 mol | D. | 18 mol |
分析 根据阴离子中核内质子数=核外电子数-电荷数,中子数=质量数-质子数,据此分析解答.
解答 解:阴离子中核内质子数=核外电子数-电荷数=18-2=16,因为质子数和中子数之和是质量数,所以中子数=32-16=16,即该元素氢化物1mol含中子数16 mol.
故选C.
点评 本题考查了离子中电子数、质子数、中子数和质量数之间的关系,难度不大,明确阳离子中核内质子数=核外电子数+电荷数,阴离子中核内质子数=核外电子数-电荷数.

练习册系列答案
相关题目
15.将X mol的Cl2通入到60mL,10.00mol•L-1的浓NaOH溶液中,加热一段时间后,溶液中只有NaCl、NaClO、NaClO3三种溶质,则下列分析合理的是( )
| A. | X=0.6mol | |
| B. | 离子的物质的量关系满足n(Cl-)=5n(ClO-)+n(ClO3-) | |
| C. | 若反应中转移的电子为n mol,则有0.3<n<0.5 | |
| D. | ClO3-的物质的量范围是:0.1mol<n(ClO3-)<0.3mol |
16.下列有关颜色变化错误的是( )
| A. | 在FeCl3溶液中滴入几滴KSCN溶液,溶液变成血红色 | |
| B. | 淡黄色溴化银见光分解后变成白色 | |
| C. | 向血红色的Fe(SCN)3溶液中加入少量KI固体,溶液颜色变浅 | |
| D. | 用50mL针筒抽取30mL红棕色的NO2气体并封住注射孔,当用力推压活塞,压缩针筒中的气体(此过程不考虑温度变化),气体颜色逐渐变深 |
8.在一定条件下的密闭容器中,一定能说明反应A(g)+3B(g)?2C(g)+2D(g)达到平衡状态的是( )
| A. | 反应体系的总压恒定 | B. | A、B的浓度相等 | ||
| C. | c(A):c(B)=1:3 | D. | 2v(B)正=3v(C)逆 |
15.下列化学式能真实表示该物质分子的是( )
| A. | 硫酸(H2SO4) | B. | 铁(Fe) | C. | 红磷(P) | D. | 氮化硼(BN) |
5.在有机物分子中,不能引入羟基的反应是( )
| A. | 还原反应 | B. | 水解反应 | C. | 消去反应 | D. | 加成反应 |
12.化学已渗透到人类生活的各个方面.下列说法不正确的是( )
| A. | 氧化铁能与酸反应,可用于制成红色涂料或颜料 | |
| B. | 烟花的绚丽缤纷是含钾、钠、钙、铜等金属元素的化合物的化学性质的展现 | |
| C. | 医用酒精是用淀粉类植物经糖化再发酵经蒸馏制成,浓度通常是75% | |
| D. | 维生素C是水溶性维生素,能增强人体抵抗力,有抗氧化作用 |
9.在1.01KPa和298K条件下,2molH2生成水蒸汽放出484kJ热量,下列热化学方程式正确的是( )
| A. | 2H2(g)+O2(g)=2H2O(l);△H=-484kJ/mol | B. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g);△H=-484kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ/mol |
10.下列有机反应方程式与反应类型均正确的是( )
| A. | CH2=CH-CH3+Cl2$\stackrel{高温}{→}$CH2=CHCH2Cl+HCl 加成反应 | |
| B. | 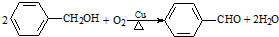 氧化反应 氧化反应 | |
| C. |  加成反应 加成反应 | |
| D. | 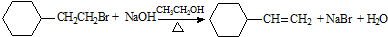 取代反应 取代反应 |