题目内容
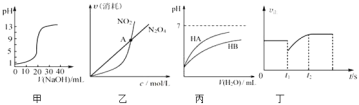
【题目】Ⅰ.酸碱中和滴定曲线是以酸碱滴定过程中滴加碱(或酸)的量或中和百分数为横坐标,以溶液 pH 为纵坐标,绘出溶液 pH 随碱(或酸)的滴加量而变化的曲线。它描述了滴定过程中溶液 pH 的变化情况,特别是滴定终点附近溶液 pH 的突变情况。下图为某浓度的 NaOH 溶液滴定 10.00mL 一定浓度的盐酸的图像

根据图像分析计算:
(1)HCl 溶液的浓度是___________,NaOH 溶液的浓度是____________。
(2)若向 20mL 稀氨水中逐滴加入等浓度的盐酸,则下列变化趋势正确的是________(填字母)。
A. 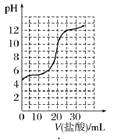 B.
B. 
C.  D.
D. 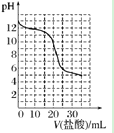
Ⅱ.下图为水在 T1℃和 T2℃时(T1<T2)对应的电离平衡曲线,回答下列问题:
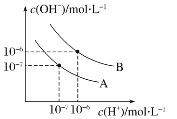
(1)在T2℃时,若10体积pH=a的某强酸溶液与1体积pH=b的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是________________。
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=11的某BOH溶液,若将二者等体积混合,混合溶液的pH>7,则BOH为_________碱,(填“强”或“弱”),判断的理由是_________。
(3)在曲线A所对应的温度下,向一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,所得混合液的pH=11,则两溶液的体积比V[Ba(OH)2]∶V(NaHSO4)=_________(假定混合液的总体积等于混合前两溶液体积之和)。
【答案】0.1000mol/L 0.05000mol/L B a+b=13 碱 若BOH是强碱,等体积混合时酸过量,此时pH<7 1:4
【解析】
Ⅰ.(1)由图可知,未滴定时,pH=1,说明盐酸中氢离子的浓度为0.1000mol/L;设该NaOH溶液的物质的量浓度分别为c(NaOH),当NaOH溶液体积为20mL,结合图象可以求解;
(2)稀氨水中,氨水电离生成铵根离子和氢氧根离子导致溶液中氢氧根离子浓度大于氢离子,所以氨水溶液呈碱性;盐酸溶液呈酸性,当向氨水溶液中加入盐酸时,盐酸和氨水发生酸碱中和反应导致溶液的pH值降低;当加入20mL盐酸时,盐酸和氨水的物质的量相等,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性;继续向溶液中加盐酸,盐酸过量,当盐酸的量远远大于氨水的物质的量时,溶液以盐酸为主,导致溶液的pH值近似于盐酸的pH值,图象中B符合;
Ⅱ.(1)升温促进水的电离,水的电离常数变大,故曲线A为T1,曲线B为T2;强酸的pH=a,强碱的pH=b,由T2℃时,若10体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,即n(H+)=n(OH);
(2)由于盐酸中c(H+)>碱BOH溶液中c(OH-),若BOH是强碱,等体积混合时酸过量,此时pH<7,则BOH是弱碱;
(3)pH=12的Ba(OH)2溶液中C(OH-)=10-2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-2mol;反应的硫酸氢钠物质的量为0.5x×10-2mol;设硫酸氢钠溶液体积为y,依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=1,由此求解。
Ⅰ.(1)由图可知,未滴定时,pH=1,说明盐酸中氢离子的浓度为0.1000mol/L,即盐酸的浓度为0.1000mol/L;设该NaOH溶液的物质的量浓度分别为c(NaOH),当NaOH溶液体积为20mL,结合图象可知,溶液呈中性,恰好反应,即:10mL×0.1000mol/L=20c(NaOH),c(NaOH)=0.05000mol/L;
(2)稀氨水中,氨水电离生成铵根离子和氢氧根离子导致溶液中氢氧根离子浓度大于氢离子,所以氨水溶液呈碱性;盐酸溶液呈酸性,当向氨水溶液中加入盐酸时,盐酸和氨水发生酸碱中和反应导致溶液的pH值降低;当加入20mL盐酸时,盐酸和氨水的物质的量相等,恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性;继续向溶液中加盐酸,盐酸过量,当盐酸的量远远大于氨水的物质的量时,溶液以盐酸为主,导致溶液的pH值近似于盐酸的pH值,图象中B符合;故选B;
Ⅱ.(1)升温促进水的电离,水的电离常数变大,故曲线A为T1,曲线B为T2;强酸的pH=a,强碱的pH=b,由T2℃时,若10体积的某强酸溶液与1体积的某强碱溶液混和后溶液呈中性,即n(H+)=n(OH),则10×10a=1×10b-12,101a=10b12,即1a=b12,则a+b=13,故答案为:a+b=13;
(2)由于盐酸中c(H+)>碱BOH溶液中c(OH-),若BOH是强碱,等体积混合时酸过量,此时pH<7,则BOH是弱碱;
(3)pH=12的Ba(OH)2溶液中C(OH-)=10-2mol/L,设溶液体积为x,得到氢氧根离子物质的量为x×10-2mol;反应的硫酸氢钠物质的量为0.5x×10-2mol;设硫酸氢钠溶液体积为y,依据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,混合后溶液pH=11,计算得到溶液中氢氧根离子浓度为10-3mol/L;所以得到:![]() =10-3,得到x:y=1:4,则所加入的Ba(OH)2溶液与NaHSO4溶液体积之比是1:4。
=10-3,得到x:y=1:4,则所加入的Ba(OH)2溶液与NaHSO4溶液体积之比是1:4。