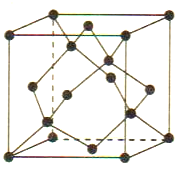
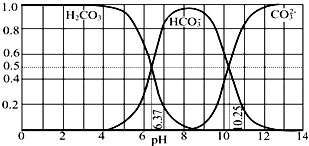
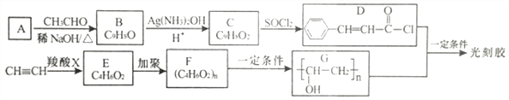
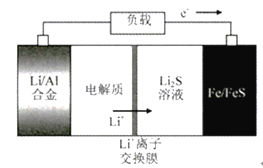
题目内容
【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10﹣14 | α | 1×10﹣12 |
试回答下列问题:
(1)若25<t1<t2 , 则α1×10﹣14(填“>”“<”或“=”),作出此判断的理由是 .
(2)25℃下,某Na2SO4溶液中c(SO42﹣)=5×10﹣4 molL﹣1 , 取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH﹣)= .
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2= . 此溶液中各种离子的浓度由大到小的排列顺序是 .
【答案】
(1)>;温度升高,水的电离程度增大,离子积增大
(2)1000:1
(3)9:11; c (Na+)>c (SO42﹣)>c (H+)>c (OH﹣)
【解析】(1)根据水的电离过程为吸热反应判断;(2)根据硫酸钠的化学式组成判断c(Na+):c(SO42﹣ ),根据常温下氢离子浓度计算c(Na+):c(OH﹣);(3)混合液的pH=2,酸过量,根据c(H+)= ![]() 计算,根据反应后溶液的组成分析各种离子的浓度大小.
计算,根据反应后溶液的组成分析各种离子的浓度大小.
解:(1)水是弱电解质,存在电离平衡,电离过程为吸热反应,所以温度升高,水的电离程度增大,离子积增大,
所以答案是:>;升高温度,水的电离程度增大,离子积增大;(2)硫酸钠溶液中一定满足c(Na+):c(SO42﹣ )=2:1;硫酸钠溶液中c(Na+)=2×5×10﹣4 molL﹣1=10﹣3稀释后c(Na+)= ![]() =10﹣4 molL﹣1,溶液呈中性,c(OH﹣)=1×10﹣7 molL﹣1,c(Na+):c(OH﹣)=1×10﹣4 molL﹣1:1×10﹣7 molL﹣1=1000:1,
=10﹣4 molL﹣1,溶液呈中性,c(OH﹣)=1×10﹣7 molL﹣1,c(Na+):c(OH﹣)=1×10﹣4 molL﹣1:1×10﹣7 molL﹣1=1000:1,
所以答案是:1000:1;(3)混合液的pH=2,酸过量,c(H+)= ![]() =
= ![]() =0.01,
=0.01,
解之得: ![]() =9:11,
=9:11,
c(Na+)=0.1×9/(9+11)=0.045mol/L
c(SO42﹣)=0.05×11/20=0.0275mol/L
c(H+)=0.01mol/L
硫酸过量溶液显酸性,c 则(H+)>c (OH﹣),
故溶液中各种离子的浓度由大到小的排列顺序是:c (Na+)>c (SO42﹣)>c (H+)>c (OH﹣),
所以答案是:9:11;c(Na+)>c(SO42﹣)>c(H+)>c(OH﹣).

 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案