题目内容
【题目】现有H、N、O、Na、Cl、Fe、Cu七种常见元素,回答下列问题:
(1)Cl位于周期表第____周期____族。
(2)Na+离子的结构示意图为____。
(3)能说明非金属性Cl比N强的事实是____(用方程式表示)。
(4)A~L是由上述七种元素中的一种、二种或三种组成,A的摩尔质量为166g·mol-1,其焰色反应呈黄色;B是最常见的液体;C中两元素的质量比为96∶7; D、E属同类物质,E呈红褐色。F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体,I是黄绿色气体;L是常见的强酸。它们有如下图所示的关系(部分反应条件及产物已略去):
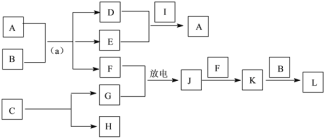
①C的化学式为____。
②D的电子式为____。
③L的稀溶液与H反应的离子方程式为____。
④反应(a)的化学方程式为____。
【答案】 三 ⅦA ![]() 3Cl2+2NH3 =N2+6HCl (或3Cl2+8NH3 =N2+6NH4Cl) Cu3N
3Cl2+2NH3 =N2+6HCl (或3Cl2+8NH3 =N2+6NH4Cl) Cu3N ![]() 3Cu + 8H++2NO3-=3Cu2++2NO↑+4H2O 4Na2FeO4 +10 H2O = 4Fe(OH)3↓+8NaOH + 3O2↑
3Cu + 8H++2NO3-=3Cu2++2NO↑+4H2O 4Na2FeO4 +10 H2O = 4Fe(OH)3↓+8NaOH + 3O2↑
【解析】(1)Cl的原子序数为17,原子结构中有3个电子层,最外层电子数为7,Cl元素位于元素周期表第三周期,第ⅦA族;(2)Na+核外存在10个电子核内有11个质子,其微粒结构示意图为:![]() ;(3)能说明非金属性Cl比N强的事实是3Cl2+2NH3 =N2+6HCl或3Cl2+8NH3 =N2+6NH4Cl;(4)A的摩尔质量为166g·mol-1,其焰色反应呈黄色,则含有钠元素;B是最常见的液体则为水; E呈红褐色则为氢氧化铁,D、E属同类物质,且D应该也含有钠元素故为氢氧化钠。F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体即为铜单质,C中两元素的质量比为96∶7;可知生成铜和氮气,故C为,G为氮气,氮气与氧气放电产生NO,故F为氧气,J为一氧化氮,与氧气反应生成K为二氧化氮,二氧化氮与水反应生成L是常见的强酸硝酸,I是黄绿色气体则为氯气;A的摩尔质量为166g·mol-1,其焰色反应呈黄色,则含有钠元素,结合D、E、F可推知A为Na2FeO4。①C的化学式为Cu3N;②D为NaOH,电子式为
;(3)能说明非金属性Cl比N强的事实是3Cl2+2NH3 =N2+6HCl或3Cl2+8NH3 =N2+6NH4Cl;(4)A的摩尔质量为166g·mol-1,其焰色反应呈黄色,则含有钠元素;B是最常见的液体则为水; E呈红褐色则为氢氧化铁,D、E属同类物质,且D应该也含有钠元素故为氢氧化钠。F、G、H、I为单质,其中F、G是无色气体,H是紫红色固体即为铜单质,C中两元素的质量比为96∶7;可知生成铜和氮气,故C为,G为氮气,氮气与氧气放电产生NO,故F为氧气,J为一氧化氮,与氧气反应生成K为二氧化氮,二氧化氮与水反应生成L是常见的强酸硝酸,I是黄绿色气体则为氯气;A的摩尔质量为166g·mol-1,其焰色反应呈黄色,则含有钠元素,结合D、E、F可推知A为Na2FeO4。①C的化学式为Cu3N;②D为NaOH,电子式为![]() ;③L的稀溶液与H反应生成硝酸铜、一氧化氮和水,反应的离子方程式为3Cu + 8H++2NO3-=3Cu2++2NO↑+4H2O;④反应(a)的化学方程式为4Na2FeO4 +10 H2O = 4Fe(OH)3↓+8NaOH + 3O2↑。
;③L的稀溶液与H反应生成硝酸铜、一氧化氮和水,反应的离子方程式为3Cu + 8H++2NO3-=3Cu2++2NO↑+4H2O;④反应(a)的化学方程式为4Na2FeO4 +10 H2O = 4Fe(OH)3↓+8NaOH + 3O2↑。

【题目】下表是不同温度下水的离子积数据:
温度/℃ | 25 | t1 | t2 |
水的离子积常数 | 1×10﹣14 | α | 1×10﹣12 |
试回答下列问题:
(1)若25<t1<t2 , 则α1×10﹣14(填“>”“<”或“=”),作出此判断的理由是 .
(2)25℃下,某Na2SO4溶液中c(SO42﹣)=5×10﹣4 molL﹣1 , 取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH﹣)= .
(3)t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1:V2= . 此溶液中各种离子的浓度由大到小的排列顺序是 .