ЬтФПФкШн
ЁОЬтФПЁПЙтПЬНКЪЧвЛжжгІгУЙуЗКЕФЙтУєВФСЯЃЌЦфКЯГЩТЗЯпШчЯТ(ВПЗжЪдМСКЭВњЮявбТдШЅ):
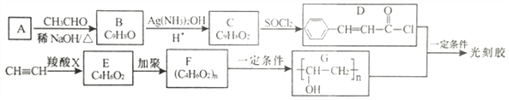
вбжЊ:
I. (R1ЁЂR2 ЮЊЬўЛљЛђЧтдзг)
(R1ЁЂR2 ЮЊЬўЛљЛђЧтдзг)
II. ![]() (R1ЁЂR2 ЮЊЬўЛљЛђЧтдзг)
(R1ЁЂR2 ЮЊЬўЛљЛђЧтдзг)
(1)AЕФЛЏбЇУћГЦЪЧ_________________ЁЃC жаЙйФмЭХЕФУћГЦЪЧ____________________ЁЃ
(2)CЁњD ЕФЗДгІРраЭЪЧ____________ЃЌE ЕФНсЙЙМђЪНЪЧ_________________________ЁЃ
(3)D+GЁњЙтПЬНКЕФЛЏбЇЗНГЬЪНЮЊ_____________________________ЁЃ
(4)HЪЧCЕФЭЌЗжвьЙЙЬхЃЌОпгаЯТСааджЪЛђЬиеї:ЂйФмЗЂЩњЫЎНтЗДгІКЭвјОЕЗДгІЃЛЂкФмЪЙфхЫЎЭЪЩЋЃЛЂлЪєгкЗМЯузхЛЏКЯЮяЃЌдђH ЕФНсЙЙга_____жжЁЃЦфжаКЫДХЙВеёЧтЦзЮЊ5зщЗхЃЌЧвЗхУцЛ§БШЮЊ1: 1:2:2:2ЕФНсЙЙМђЪНЮЊ_____________________________ЁЃ
(5)ИљОнвбгажЊЪЖВЂНсНсКЯЯрЙиаХЯЂЃЌаДГівдCH3CH2OHЮЊдСЯжЦБИCH3CH2CH2CH2OHЕФКЯГЩТЗЯпСїГЬЭМ(ЮоЛњЪдМСШЮгУ)___________________________________________ЁЃКЯГЩТЗЯпСїГЬЭМЪОР§ШчЯТ:
![]()
ЁОД№АИЁП БНМзШЉ єШЛљЁЂЬМЬМЫЋМќ ШЁДњЗДгІ CH3COOCH=CH2 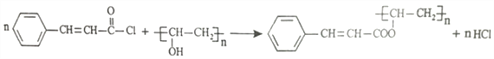 5
5 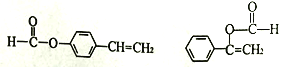 CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2 CH2OH
CH3CH2CH2 CH2OH
ЁОНтЮіЁПгЩDЕФНсЙЙПЩжЊЃЌAжаКЌгаБНЛЗЃЌAгыCH3CHOЗДгІЕУЕНBЃЌгЩЮяжЪЕФЗжзгЪНМАаХЯЂЂёЃЌПЩЭЦжЊAЮЊ![]() ЃЌBЮЊ
ЃЌBЮЊ![]() ЃЌBгывјАБШмвКЗЂЩњбѕЛЏЗДгІЁЂЫсЛЏЕУЕНCЃЌдђCЮЊ
ЃЌBгывјАБШмвКЗЂЩњбѕЛЏЗДгІЁЂЫсЛЏЕУЕНCЃЌдђCЮЊ![]() ЁЃввШВКЭєШЫсXМгГЩЩњГЩEЃЌEЗЂЩњМгОлЗДгІЕУЕНFЃЌдђEЗжзгжаКЌгаC=CЫЋМќЃЌНсКЯЗжзгЪНПЩжЊЃЌXЮЊCH3COOHЃЌИљОнGЕФНсЙЙПЩжЊFЮЊ
ЁЃввШВКЭєШЫсXМгГЩЩњГЩEЃЌEЗЂЩњМгОлЗДгІЕУЕНFЃЌдђEЗжзгжаКЌгаC=CЫЋМќЃЌНсКЯЗжзгЪНПЩжЊЃЌXЮЊCH3COOHЃЌИљОнGЕФНсЙЙПЩжЊFЮЊ![]() ЃЌЙЪEЮЊCH3COOCH=CH2ЃЛGгыDЗЂЩњаХЯЂЂђЕФЗДгІЕУЕНЙтПЬНКЃЌдђЙтПЬНКЕФНсЙЙМђЪНЮЊЃК
ЃЌЙЪEЮЊCH3COOCH=CH2ЃЛGгыDЗЂЩњаХЯЂЂђЕФЗДгІЕУЕНЙтПЬНКЃЌдђЙтПЬНКЕФНсЙЙМђЪНЮЊЃК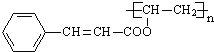 ЁЃ
ЁЃ
(1)ЭЈЙ§вдЩЯЗжЮіжЊЃЌAНсЙЙМђЪНЮЊ![]() ЃЌУћГЦЮЊБНМзШЉЃЌCЮЊ
ЃЌУћГЦЮЊБНМзШЉЃЌCЮЊ![]() ЃЌЙйФмЭХЮЊєШЛљЁЂЬМЬМЫЋМќЃЌЙЪД№АИЮЊЃКБНМзШЉЃЛєШЛљЁЂЬМЬМЫЋМќЃЛ
ЃЌЙйФмЭХЮЊєШЛљЁЂЬМЬМЫЋМќЃЌЙЪД№АИЮЊЃКБНМзШЉЃЛєШЛљЁЂЬМЬМЫЋМќЃЛ
(3)гЩЩЯЪіЗжЮіПЩжЊЃЌCЮЊ![]() ЃЌгыSOCl2ЗЂЩњШЁДњЗДгІЩњГЩ
ЃЌгыSOCl2ЗЂЩњШЁДњЗДгІЩњГЩ![]() ЃЛEЕФНсЙЙМђЪНЮЊЃКCH3COOCH=CH2ЃЌЙЪД№АИЮЊЃКШЁДњЗДгІЃЛCH3COOCH=CH2ЃЛ
ЃЛEЕФНсЙЙМђЪНЮЊЃКCH3COOCH=CH2ЃЌЙЪД№АИЮЊЃКШЁДњЗДгІЃЛCH3COOCH=CH2ЃЛ
(3)GгыDЗЂЩњаХЯЂЂђЕФЗДгІЕУЕНЙтПЬНКЃЌдђЙтПЬНКЕФНсЙЙМђЪНЮЊЃК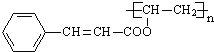 ЃЌИУЗДгІЗНГЬЪНЮЊЃК
ЃЌИУЗДгІЗНГЬЪНЮЊЃК![]() ЃЌЙЪД№АИЮЊЃК
ЃЌЙЪД№АИЮЊЃК![]() ЃЛ
ЃЛ
(4) CЮЊ![]() ЃЌHЪЧCЕФЭЌЗжвьЙЙЬхЃЌОпгаЯТСааджЪЛђЬиеї:ЂйФмЗЂЩњЫЎНтЗДгІЃЌЫЕУїНсЙЙжаКЌгаѕЅЛљЃЌФмЙЛЗЂЩњвјОЕЗДгІЃЌЫЕУїКЌгаШЉЛљЃЌЫЕУїЪєгкМзЫсѕЅРрЃЛЂкФмЪЙфхЫЎЭЪЩЋЃЌЫЕУїКЌгаЬМЬМЫЋМќЃЛЂлЪєгкЗМЯузхЛЏКЯЮяЃЌдђHЕФНсЙЙгаЃКБНЛЗЩЯКЌга2ИіВрСДЃЌвЛИіЁЊCH=CH2КЭвЛИіHCOOЁЊга3жжНсЙЙЃЛБНЛЗЩЯКЌга1ИіВрСДЃЌВрСДПЩФмЮЊHCOOЁЊCH=CHЁЊЁЂ
ЃЌHЪЧCЕФЭЌЗжвьЙЙЬхЃЌОпгаЯТСааджЪЛђЬиеї:ЂйФмЗЂЩњЫЎНтЗДгІЃЌЫЕУїНсЙЙжаКЌгаѕЅЛљЃЌФмЙЛЗЂЩњвјОЕЗДгІЃЌЫЕУїКЌгаШЉЛљЃЌЫЕУїЪєгкМзЫсѕЅРрЃЛЂкФмЪЙфхЫЎЭЪЩЋЃЌЫЕУїКЌгаЬМЬМЫЋМќЃЛЂлЪєгкЗМЯузхЛЏКЯЮяЃЌдђHЕФНсЙЙгаЃКБНЛЗЩЯКЌга2ИіВрСДЃЌвЛИіЁЊCH=CH2КЭвЛИіHCOOЁЊга3жжНсЙЙЃЛБНЛЗЩЯКЌга1ИіВрСДЃЌВрСДПЩФмЮЊHCOOЁЊCH=CHЁЊЁЂ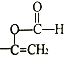 2жжНсЙЙЃЌЙВ5жжЃЛЦфжаКЫДХЙВеёЧтЦзЮЊ5зщЗхЃЌЧвЗхУцЛ§БШЮЊ1: 1:2:2:2ЕФНсЙЙМђЪНЮЊ
2жжНсЙЙЃЌЙВ5жжЃЛЦфжаКЫДХЙВеёЧтЦзЮЊ5зщЗхЃЌЧвЗхУцЛ§БШЮЊ1: 1:2:2:2ЕФНсЙЙМђЪНЮЊ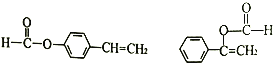 ЃЌЙЪД№АИЮЊЃК5ЃЛ
ЃЌЙЪД№АИЮЊЃК5ЃЛ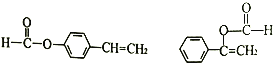 ЃЛ
ЃЛ
(5)вдCH3CH2OHЮЊдСЯжЦБИCH3CH2CH2CH2OHЃЌЪзЯШввДМДпЛЏбѕЛЏЩњГЩввШЉЃЌввШЉдкМгШШЬѕМўЯТКЭЯЁNaOHШмвКЗДгІЩњГЩCH3CH=CHCHOЃЌCH3CH=CHCHOгыЧтЦјМгГЩМДПЩЃЌКЯГЩТЗЯпЮЊCH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2 CH2OHЃЌЙЪД№АИЮЊЃКCH3CH2OH
CH3CH2CH2 CH2OHЃЌЙЪД№АИЮЊЃКCH3CH2OH![]() CH3CHO
CH3CHO![]() CH3CH=CHCHO
CH3CH=CHCHO![]() CH3CH2CH2 CH2OHЁЃ
CH3CH2CH2 CH2OHЁЃ

 ЛюСІЪдОэЯЕСаД№АИ
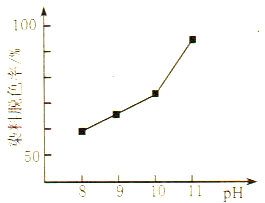
ЛюСІЪдОэЯЕСаД№АИ ПЮПЮгХФмСІХргХ100ЗжЯЕСаД№АИ
ПЮПЮгХФмСІХргХ100ЗжЯЕСаД№АИЁОЬтФПЁПЯТБэЪЧВЛЭЌЮТЖШЯТЫЎЕФРызгЛ§Ъ§ОнЃК
ЮТЖШ/Ёц | 25 | t1 | t2 |
ЫЎЕФРызгЛ§ГЃЪ§ | 1ЁС10Љ14 | ІС | 1ЁС10Љ12 |
ЪдЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉШє25ЃМt1ЃМt2 ЃЌ дђІС1ЁС10Љ14ЃЈЬюЁАЃОЁБЁАЃМЁБЛђЁА=ЁБЃЉЃЌзїГіДЫХаЖЯЕФРэгЩЪЧ ЃЎ
ЃЈ2ЃЉ25ЁцЯТЃЌФГNa2SO4ШмвКжаcЃЈSO42ЉЃЉ=5ЁС10Љ4 molLЉ1 ЃЌ ШЁИУШмвК1mLЃЌМгЫЎЯЁЪЭжС10mLЃЌдђЯЁЪЭКѓШмвКжаc ЃЈNa+ЃЉЃКc ЃЈOHЉЃЉ= ЃЎ
ЃЈ3ЃЉt2ЁцЯТЃЌНЋpH=11ЕФПСадФЦШмвКV1 LгыpH=1ЕФЯЁСђЫсV2 LЛьКЯЃЈЩшЛьКЯКѓШмвКЕФЬхЛ§ЮЊдСНШмвКЬхЛ§жЎКЭЃЉЃЌЫљЕУЛьКЯШмвКЕФpH=2ЃЌдђV1ЃКV2= ЃЎ ДЫШмвКжаИїжжРызгЕФХЈЖШгЩДѓЕНаЁЕФХХСаЫГађЪЧ ЃЎ