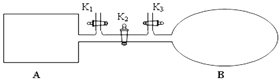
题目内容
【题目】硫代硫酸钠晶体![]() 又名大苏打、海波,主要用于照相业作定影剂、鞣革时作还原剂。易溶于水,遇酸易分解。实验室可用如下装置
又名大苏打、海波,主要用于照相业作定影剂、鞣革时作还原剂。易溶于水,遇酸易分解。实验室可用如下装置![]() 略去部分加持仪器
略去部分加持仪器![]() 模拟生成过程。
模拟生成过程。
(1)实验室可利用![]() 晶体和质量分数为
晶体和质量分数为![]() 的硫酸制备
的硫酸制备![]() 气体,该反应中硫酸浓度不能太大的原因是_________________________。
气体,该反应中硫酸浓度不能太大的原因是_________________________。
(2)在C中制取硫代硫酸钠晶体时,先向C中烧瓶加入![]() 和
和![]() 混合溶液,再向A中烧瓶滴加
混合溶液,再向A中烧瓶滴加![]() 。则装置C中发生反应生成
。则装置C中发生反应生成![]() 的化学方程式为_________
的化学方程式为_________
(3)实验中,为使![]() 缓慢通入烧瓶C,采取的操作是_____________。装置D的作用是_______________。装置E中为__________溶液。
缓慢通入烧瓶C,采取的操作是_____________。装置D的作用是_______________。装置E中为__________溶液。
(4)继续通入![]() 气体至溶液PH接近7,停止通入气体,取下C,过滤。实验过程中若没及时停止通入气体,可能产生的后果是______________。反应终止后,烧瓶C中除析出
气体至溶液PH接近7,停止通入气体,取下C,过滤。实验过程中若没及时停止通入气体,可能产生的后果是______________。反应终止后,烧瓶C中除析出![]() ,其中可能含有
,其中可能含有![]() 杂质。为减少杂质
杂质。为减少杂质![]() 的量,第
的量,第![]() 步操作应稍作改动,具体操作是___________________
步操作应稍作改动,具体操作是___________________
(5)![]() 的溶解度随温度升高显著增大,所得粗产品通过_____________方法提纯。海波可用于摄影上的定影剂,因为它能与卤化银起化学反应,生成易溶于水的银络合物
的溶解度随温度升高显著增大,所得粗产品通过_____________方法提纯。海波可用于摄影上的定影剂,因为它能与卤化银起化学反应,生成易溶于水的银络合物![]() ,冲走胶片上多余的感光剂起定影作用,溴化银与海波反应的离子方程式为__________
,冲走胶片上多余的感光剂起定影作用,溴化银与海波反应的离子方程式为__________
【答案】浓硫酸中![]() 很小,复分解反应速率慢
很小,复分解反应速率慢 ![]() 控制滴加硫酸的速度
控制滴加硫酸的速度![]() 合理即可
合理即可![]() 防止倒吸
防止倒吸 ![]() 合理即可
合理即可![]()
![]() 遇酸易分解,在酸性条件下不稳定,产率降低 先向A中烧瓶滴加浓
遇酸易分解,在酸性条件下不稳定,产率降低 先向A中烧瓶滴加浓![]() ,待产生的气体将装置中空气排尽后,再向C中烧瓶加入
,待产生的气体将装置中空气排尽后,再向C中烧瓶加入![]() 和
和![]() 混合溶液 重结晶
混合溶液 重结晶 ![]()
![]()
【解析】
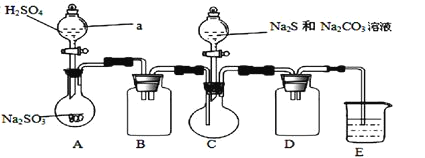
装置A为SO2的制取:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,B装置为Na2S2O3的生成装置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,C装置中![]() 和
和![]() 和
和![]() 混合溶液发生反应生成
混合溶液发生反应生成![]() ,二氧化硫有毒不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以E为尾气吸收装置,吸收未反应的SO2,应该盛放碱性物质,一般采用NaOH溶液;
,二氧化硫有毒不能直接排空,且二氧化硫属于酸性氧化物,能和碱反应生成盐和水,所以E为尾气吸收装置,吸收未反应的SO2,应该盛放碱性物质,一般采用NaOH溶液;
(1)稀硫酸浓度太小或过高,都会使硫酸中氢离子浓度过小,反应产生二氧化硫的速率减慢;
(2)![]() 和
和![]() 和
和![]() 混合溶液发生反应生成
混合溶液发生反应生成![]() ;
;
(3)分液漏斗可控制反应液体的流速,D为安全瓶,E为尾气吸收装置,防止二氧化硫进入空气;
(4) Na2S2O3在酸性条件下反应生成S、SO2和水;根据亚硫酸钠易被氧化生成硫酸钠分析;
(5)根据![]() 的溶解度分析提纯方法;
的溶解度分析提纯方法;
(1)制备![]() 气体时,不使用浓度太大的硫酸是因为浓硫酸中
气体时,不使用浓度太大的硫酸是因为浓硫酸中![]() 很小,复分解反应速率慢;
很小,复分解反应速率慢;
(2)![]() 中生成
中生成![]() ,在C中
,在C中![]() 和
和![]() 和
和![]() 混合溶液发生反应生成
混合溶液发生反应生成![]() ,其化学方程式为
,其化学方程式为![]() ;
;
(3)为使![]() 缓慢通入烧瓶C,可采取的措施是控制滴加硫酸的速度;D装置的作用是安全瓶,防止倒吸;E为收集未完全反应的
缓慢通入烧瓶C,可采取的措施是控制滴加硫酸的速度;D装置的作用是安全瓶,防止倒吸;E为收集未完全反应的![]() 及其他酸性气体,则其为NaOH溶液;
及其他酸性气体,则其为NaOH溶液;
(4)实验过程中若没及时停止通入![]() ,则会使溶液为酸性,
,则会使溶液为酸性,![]() 遇酸易分解,在酸性条件下不稳定,产率降低;
遇酸易分解,在酸性条件下不稳定,产率降低;![]() 有还原性,可被氧气氧化为
有还原性,可被氧气氧化为![]() ,所以可以先向A中烧瓶滴加浓
,所以可以先向A中烧瓶滴加浓![]() ,待产生的气体将装置中空气排尽后,再向C中烧瓶加入
,待产生的气体将装置中空气排尽后,再向C中烧瓶加入![]() 和
和![]() 混合溶液;
混合溶液;
(5)得到粗产品后,因为![]() 的溶解度随温度升高显著增大,可用重结晶的方法提纯;由题可知,溴化银与海波反应的离子方程式为
的溶解度随温度升高显著增大,可用重结晶的方法提纯;由题可知,溴化银与海波反应的离子方程式为![]() 。
。

【题目】硼镁泥是硼镁矿生产硼砂晶体(Na2B4O7·10H2O)时的废渣,其主要成分是MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:

回答下列问题:
(l)Na2B4O7·10H2O中B的化合价为__________。
(2)Na2B4O7易溶于水,也易发生水解:B4O72-+7H2O![]() 4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
4H3BO3(硼酸)+2OH-(硼酸在常温下溶解度较小)。写出加入硫酸时Na2B4O7发生反应的化学方程式:______________。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) 溶解度(g) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取NaBH4,NaBH4被称为有机化学中的“万能还原剂”。
①写出NaBH4的电子式:___________。
②“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克H2的还原能力。NaBH4的有效氢含量为_________(保留两位小数)。
③在碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,写出阴极室的电极反应式:________。