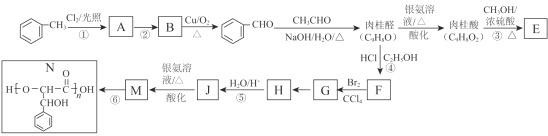
题目内容
【题目】C、N、S是重要的非金属元素,按要求回答下列问题:
(1)烟道气中含有的CO和SO2是重要的污染物,可在催化剂作用下将它们转化为S(s)和CO2,此反应的热化学方程式为______________________________________________________。
已知:CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1。
(2)向甲、乙两个均为1 L的密闭容器中,分别充入5 mol SO2和3 mol O2,发生反应:2SO2(g)+
O2(g)![]() 2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
2SO3(g) ΔH<0。甲容器在温度为T1的条件下反应,达到平衡时SO3的物质的量为4.5 mol;乙容器在温度为T2的条件下反应,达到平衡时SO3的物质的量为4.6 mol。则T1___T2(填“>”、“<”),甲容器中反应的平衡常数K=_____________________。
(3)如图所示,A是恒容的密闭容器,B是一个体积可变的充气气囊。保持恒温,关闭K2,分别将1 mol N2和3 mol H2通过K1、K3充入A、B中,发生的反应为:N2(g)+3H2(g) ![]() 2NH3(g),起始时A、B的体积相同均为a L。
2NH3(g),起始时A、B的体积相同均为a L。
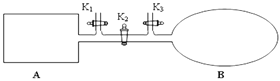
①下列示意图既能说明A容器中反应达到平衡状态,又能说明B容器中反应达到平衡状态的是______。
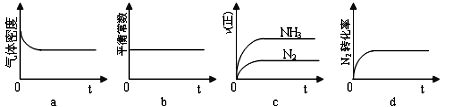
②容器A中反应到达平衡时所需时间t s,达到平衡后容器的压强变为原来的5/6,则平均反应速率υ(H2)=___________________________。
(4)将0.1 mol氨气分别通入1 L pH=1的盐酸、硫酸和醋酸溶液中,完全反应后三溶液中NH4+离子浓度分别为c1、c2、c3,则三者浓度大小的关系为____________(用“c1、c2、c3和>、<、=”表示)。已知醋酸铵溶液呈中性,常温下CH3COOH的Ka=1×10-5 mol·L-1,求该温度下NH4Cl的水解常数K h 为_________。
【答案】2CO(g)+SO2(g)=S(s)+2CO2(g) ΔH= -270 kJ·mol-1 > 108 L·mol-1或108 d 1/at mol·L-1·s-1 c1=c2<c3 10-9 mol/L或10-9
【解析】
本题考查热化学方程式的书写,利用三段式进行,化学平衡常数的计算,溶液中离子浓度的大小关系以及盐类的水解等知识,综合性较强,有一定难度。
(1)①CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
②S(s)+O2(g)=SO2(g) ΔH=-296.0 kJ·mol-1
根据盖斯定律,反应①×2-反应②即可,2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ·mol-1
故答案为:2CO(g)+SO2(g)=S(s)+2CO2(g)△H=-270kJ·mol-1 。
(2)因为反应正向为放热,所以三氧化硫增多,说明平衡正向移动,温度降低,选>
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始物质的量5 3 0
改变物质的量4.5 2.25 4.5
平衡物质的量0.5 0.75 4.5
的密闭容器的体积为1 L,根据方程式计算得,平衡时二氧化硫的浓度为0.5mol/L,氧气的浓度为0.75mol/L,三氧化硫的浓度为4.5molL,所以平衡常数=4.5×4.5/(0.5×0.5×0.75)=108L·mol-1或108;
故答案为:108 L·mol-1或108。
(3)①a、A中气体的密度始终不变,而B中的密度随体积变化而变化,平衡时不变;
b、反应过程中平衡常数始终不变,不能说明平衡;
c、正反应起点最大,所以错误;
d、氮气的转化率逐渐增大,最后不变,说明反应到平衡。
选d。
② N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始物质的量1 3 0
改变物质的量x 3x 2x
平衡物质的量1-x 3-3x 2x
(1-x+3-3x+2x)/(1+3)=5/6解x=1/3所以氢气的反应速率=1/atmol·L-1·S-1。
故答案为:1/atmol·L-1·S-1。
(4)盐酸和硫酸完全反应,醋酸有剩余,对铵根离子水解抑制作用,所以在醋酸溶液中铵根离子浓度最大,关系为c1=c2<c3,因为醋酸铵为中性,说明醋酸的电离程度=氨水的电离程度,铵盐的水解平衡常数=10-14/10-5=10-9;故答案为:10-9 mol/L或10-9 。

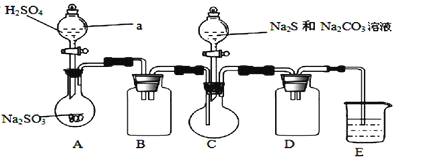
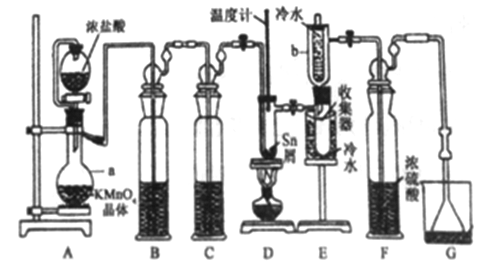
【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9C)与Cl2 反应制备SnCl4装置如下图所示。
已知,① SnCl4在空气中极易水解生成SnO2xH2O;②SnCl2、SnCl4有关物理性质如下表。
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
回答下列问题:
(1)仪器a的名称是__________,其中发生反应的离子方程式为________。
(2)装置B、C 中盛装的试剂分别是_______、__________。
(3)当观察到装置F液面上方出现_____现象时才开始点燃酒精灯,待锡熔化后适当增大氯气流量,继续加热。此时继续加热的目的有:①加快氯气与锡反应,②__________。
(4)E装置中b的作用是___________。
(5)若制得产品中含有少量Cl2,则可采用下列_____(填字母)措施加以除去。
A.加入NaOH 萃取分液 B.加入足量锡再加热蒸馏
C.加入碘化钾冷凝过滤 D.加入饱和食盐水萃取
(6)可用滴定法测定最后产品的纯度。准确称取该样品mg加入到适量浓盐酸溶解,然后再加水稀释至250 mL,用移液管移取25.00 ml,稀释后的溶液于锥形瓶中,加入两滴淀粉溶液作指示制,用cmol/L 的KIO3 标准溶液进行滴定,平行滴定3 次,平均消耗V mL的标准溶液。已知滴定时发生的反应为:Sn2++IO3-+H+→Sn4++I2+H2O(未配平)。回答下列问题:
①判断达到滴定终点的现象为____________。
②产品中SnCl2(摩尔质量为M g/mol )的含量为____%(用含m、c、V、M 的代数式表示)。
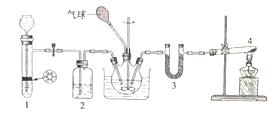
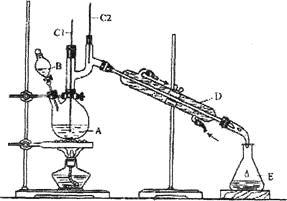
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
发生的反应如下:
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm﹣3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)上述装置图中,B仪器的名称是__________,D仪器的名称是__________;
(2)加入沸石的作用是__________;
(3)分液漏斗使用前必须进行的操作是__________ (填正确答案标号);
a.润湿 b.干燥 c.检漏 d.标定
(4)将正丁醛粗产品置于分液漏斗中分水时,水在__________层(填“上”或“下”);
(5)反应温度应保持在90~95℃。其原因是______________________________;
(6)本实验中,正丁醛的产率为__________%。